Статья 26. Условия получения права на управление транспортными средствами / КонсультантПлюс
Статья 26. Условия получения права на управление транспортными средствами
(в ред. Федерального закона от 07.05.2013 N 92-ФЗ (ред. 02.07.2013))
КонсультантПлюс: примечание.
Об особенностях реализации примерных программ профессионального обучения водителей транспортных средств соответствующих категорий и подкатегорий см. Разъяснения Минобрнауки России.
1. К сдаче экзаменов допускаются лица, достигшие установленного настоящей статьей возраста, имеющие медицинское заключение об отсутствии противопоказаний к управлению транспортными средствами, прошедшие в установленном порядке соответствующее профессиональное обучение.
Примерные программы профессионального обучения водителей транспортных средств соответствующих категорий и подкатегорий разрабатываются уполномоченными на то федеральными органами исполнительной власти в порядке, определяемом Правительством Российской Федерации.
2. Право на управление транспортными средствами предоставляется:
транспортными средствами категории «M» и подкатегории «A1» — лицам, достигшим шестнадцатилетнего возраста;
транспортными средствами категорий «A», «B», «C» и подкатегорий «B1», «C1» — лицам, достигшим восемнадцатилетнего возраста;
транспортными средствами категорий «D», «Tm», «Tb» и подкатегории «D1» — лицам, достигшим двадцатиоднолетнего возраста;
составами транспортных средств категорий «BE», «CE», «DE» — лицам, имеющим право на управление транспортными средствами соответственно категорий «B», «C», «D» в течение не менее двенадцати месяцев;
составами транспортных средств подкатегорий «C1E», «D1E» — лицам, имеющим право на управление транспортными средствами соответственно категорий «C», «D» либо подкатегорий «C1», «D1» в течение не менее двенадцати месяцев.
3. Лица, достигшие семнадцатилетнего возраста, допускаются к сдаче экзаменов на право управления транспортными средствами категорий «B» и «C» при соблюдении условий, предусмотренных пунктом 1 настоящей статьи.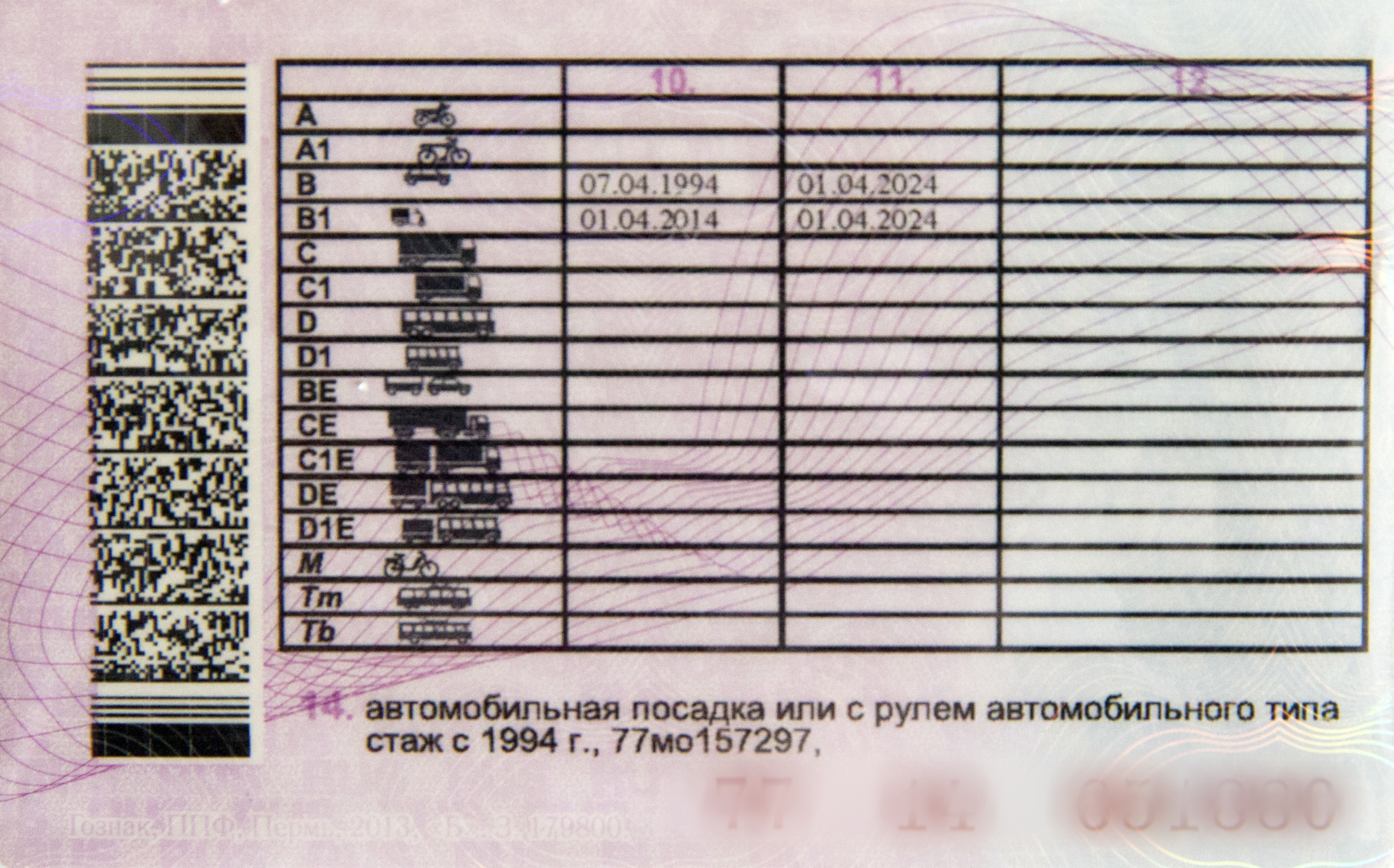
Российские национальные водительские удостоверения выдаются указанным лицам по достижении ими восемнадцатилетнего возраста.
4. Лица, проходящие военную службу, после соответствующего профессионального обучения допускаются к сдаче экзаменов на право управления транспортными средствами категории «D» и подкатегории «D1» по достижении девятнадцатилетнего возраста.
До достижения указанными лицами двадцатиоднолетнего возраста выданные им по результатам сдачи экзаменов российские национальные водительские удостоверения подтверждают право на управление транспортными средствами категории «D» и подкатегории «D1», принадлежащими только Вооруженным Силам Российской Федерации, другим войскам, воинским формированиям и органам, в которых федеральными законами предусмотрена военная служба.
5. Действие требований, установленных настоящей статьей, может быть изменено или исключено в отношении участников экспериментального правового режима в сфере цифровых инноваций в соответствии с программой экспериментального правового режима в сфере цифровых инноваций, утверждаемой в соответствии с Федеральным законом от 31 июля 2020 года N 258-ФЗ «Об экспериментальных правовых режимах в сфере цифровых инноваций в Российской Федерации».
(п. 5 введен Федеральным законом от 02.07.2021 N 331-ФЗ)
Открыть полный текст документа
Автошкола ПИОНЕР Раменское обучение на права категории A, B, С, D, E в Раменском районе
Автошкола в Раменском ПИОНЕР проводит подготовку водителей транспортных средств категорий А, B, C, D, E. У нас отличный высокопрофессиональный состав — опытные преподаватели и инструкторы, превращающие обучение на водительские права в приятное занятие, которое Вы будете посещать с удовольствием.
Автошкола «ПИОНЕР» в городе Раменское готовит новых водителей для современного мегаполиса: аккуратных, внимательных, знающих, а главное безопасных для себя и окружающих! Классно водить машину, уметь быстро и адекватно ориентироваться в дорожной обстановке, знать азы устройства автомобиля и его систем — все эти знания можно получить за время обучения на наших курсах вождения.
Автошкола «ПИОНЕР» соответствует всем установленным высоким стандартам и требованиям. Наличие лицензий лишний раз подтверждает высокий уровень организации учебного процесса, грамотный подход к приобретению навыков вождения в Раменском.
Наличие лицензий лишний раз подтверждает высокий уровень организации учебного процесса, грамотный подход к приобретению навыков вождения в Раменском.
важно
Сдача экзамена в ГИБДД проходит только на нашем автодроме и на тех автомобилях, на которых Вы обучались, в том числе и экзамен по городу.Мы предлагаем Вам отличные условия для учебы
Высокая квалификация преподавательского состава и профессионализм инструкторов
Наличие собственного автопарка учебных машин современных иностранных моделей
Собственный большой и оснащенный всем необходимым автодром (учебная площадка площадью 0.5 га, освещаемая в темное время суток)
Компьютеризированный учебный класс
Учебная литература в подарок
Гибкий и удобный график проведения занятий
Индивидуальный подход в подготовке каждого ученика
Подготовка пакета документов для сдачи экзамена в ГИБДД (свидетельство, водительская карточка)
Наличие первоклассного современного оборудования для обучения: от мультимедиа до интерактивных устройств
Улыбка и доброжелательное отношение со стороны администрации
Выбор автошколы — это ответственное занятие, к которому необходимо подойти со всей серьезностью.
Мы ждем вас в нашей школе вождения по адресу: г. Раменское, ул.Чугунова, д.15А, помещение 20, домофон 20. Более подробная информация по телефону: 8 (800) 550-47-22 — звонок бесплатный
Сделать заявку на бесплатное посещение
Водительская справка категории D
Водительское удостоверение категории D дает право на управление автобусом с количеством пассажиров более 16 человек. Владелец прав категории D может так же дополнять автобус прицепом, вес которого не превышает 750 килограмм.
Порядок и сроки оформления, перечень обследований, стоимость категории D >>>
Как открыть категорию D?
Чтобы открыть любую новую категорию, необходимо предварительно пройти обучение в автошколе и сдать экзамен в ГИБДД. Для этого кандидату потребуется прохождение соответствующей медицинской комиссии.
Как пройти водительскую комиссию категории D?
Для прохождения медосмотра необходимо обратиться в медицинское учреждение. Это может быть государственная поликлиника или частный медицинский центр.
Внимание! Водительская справка категории D – официальный документ, который регистрируется в базе ГИБДД. Выдавать такие справки могут только лицензированные медицинские учреждения. Обязательно уточняйте наличие соответствующей лицензии (на проведение медицинского освидетельствования водителей, кандидатов в водители транспортных средств) и необходимых специалистов.
Какие специалисты и обследования требуются для прохождения водительской комиссии кат D?
Кроме терапевта, нарколога, психиатра и окулиста для водителей данной категории обязательным является осмотр у врача-невролога, отоларинголога, а также обследование головного мозга (ЭЭГ).
Документы для прохождения медицинского осмотра
Основным документом является паспорт. Для водительской комиссии могут также потребоваться фотографии (3х4) и водительское удостоверение (в случае замены прав или внесения изменений)
Официально и быстро получить водительскую справку кат D вы можете, обратившись в один из центров сети «Медкомиссия №1». Все филиалы лицензированы, работают все необходимые специалисты. Медосмотр проводится в кратчайшие сроки и занимает в среднем 30-40 минут.
Все филиалы лицензированы, работают все необходимые специалисты. Медосмотр проводится в кратчайшие сроки и занимает в среднем 30-40 минут.
Адреса филиалов в Санкт-Петербурге:
- ул. Народная, дом 1
- ул. Салова, дом 63
- пр. Богатырский, дом 35, корпус 1
- пр. Просвещения, дом 50
- ул. Солдата Корзуна, дом 4
- ул. Ленсовета, дом 41
- ул. Наличная, дом 28/16
- пл. красногвардейскя, дом 5.
Звоните и записывайтесь на получение справки по телефону +7 (812) 380-82-54
Порядок и сроки оформления, перечень обследований, стоимость категории D >>>
Категории и подкатегории прав в водительских удостоверениях
Перед тем, как проходить обучение вождению в автошколе, будущий автомобилист решает, какая категория прав ему нужна. Еще недавно было всего пять категорий, но недавно ввели дополнительные, так что на данный момент всего их 12 штук, которые дают право на управление разными видами транспорта.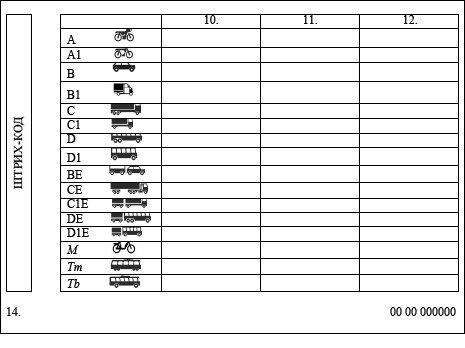
Действующие категории ВУ
Основных категорий, как уже было сказано выше, пять. Сегодня инструкторы по вождению обучают именно на них.
Категория А
К «A» относятся различные мотоциклы, мотороллеры, а также все другие, так называемые, мототранспортные средства.
Категория B
Следующая и самая распространенная категория — это «В». Сюда относятся автомобили с допустимой массой максимум 3,5 тонны. Сидячих мест в авто (кроме водительского сиденья) не должно превышать восьми.
Категория C
«C» — это автомобили, чья масса превышает 3,5 тонн, но за исключением транспорта, который относится уже к категории «D».
Категория D
К «D» относятся автомобили для перевозки пассажиров, то есть число мест в них больше восьми.
Категория E
Категории Е (это BE, далее идет CE, а также DE) — это авто с прицепом, чья масса более 750 кг.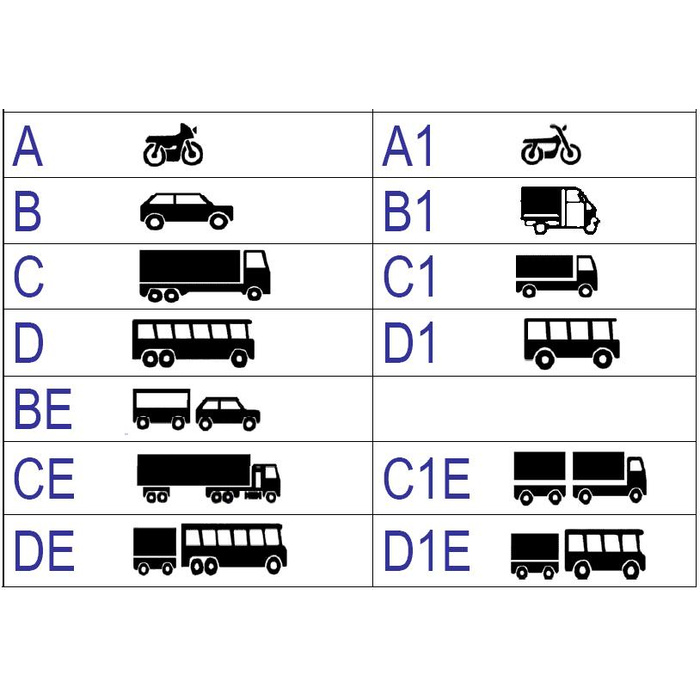
Новые подкатегории водительских прав
Как известно, недавно в сфере образования для водителей произошли некоторые изменения, и в законодательство были внесены поправки.
Какие же подкатегории появились? Это в основном категории с цифрой 1.
Подкатегория А1
Так, подкатегория «А1» подразумевает управление мотоциклом, рабочий объем мотора которого составляет 125 см
Если у вас уже есть категория «А», то учиться дополнительно на «А1» не нужно, то есть вы можете управлять мотоциклами с вышеуказанными параметрами.
Подкатегория В1
К данной категории специалисты решили отнести квадрициклы и трициклы. Не нужно путать эти два понятия. Легкие квадрициклы — это четырехколесные ТС, чья масса не превышает в ненагруженном состоянии 3,5 тонны (масса берется без учета веса аккумулятора), и чья максимальная скорость, предусмотренная предприятием-изготовителем не выше 50 км/ч.
Подкатегория «В1» позволяет управлять не только легкими квадрициклами, но и другим четырехколесным транспортом, чья ненагруженная масса не превышает четырех тонн.
Для ТС, предназначенного для грузоперевозок, данная цифра составляет 5,5 тонн. Здесь опять же не берется в расчет масса аккумулятора, если транспортное средство является электрическим. Что касается максимальной мощности двигателя, то она не должна быть выше 15 кВт.
Трицикл, как видно из названия, представляет собой трехколесное ТС, где колеса симметричны по отношению к продольной средней плоскости ТС. У трициклов рабочий объем мотора (если он относится к двигателям внутреннего сгорания) больше 50 см3, а максимально возможная скорость, предусмотренная конструкцией (при любом типе двигателя), выше 50 км в час.
Что касается мопедов, то это ТС с двумя (реже с тремя колесами). В последнем случае колеса могут располагаться в любом порядке. Максимальная скорость мопеда не должна быть выше 50 км в час.
Категория С1
Подкатегория «С1» включает в себя автомобили с массой 3,5-7,5 (это максимум) тонн. Это легкие грузовики, а также автомобили с легким прицепом (опять же до 7,5 т.). Если у водителя уже открыта категория «С», то ему разрешено управлять транспортом из подкатегории «С1».
Есть также «С1Е», куда относятся автомобили из «С1», но с прицепом, где масса выше 7,5 т.
Однако здесь стоит напомнить, что масса такого состава в целом не может быть выше 12 тысяч килограмм.
Имея категорию «CE», можно ездить на ТС из «C1E».
Категория D и ее производные
К этой категории относят автомобили, которые предназначены для пассажиро-перевозок, где 8 и более сидячих мест (кроме водительского). Сюда же входят транспортные средства с прицепом, чья масса, как было сказано выше, не более 750 кг.
Имея категорию «D», вы сможете водить автобусы, неважно сколько они будут весить, а также же автобусы с прицепом (до 750 кг). Если прицеп весит больше, или если это сочлененный автобус, то потребуется ВУ с категорией «DE».
Если прицеп весит больше, или если это сочлененный автобус, то потребуется ВУ с категорией «DE».
Что касается «D1», то это категория для пассажирских перевозок. Например, можно управлять небольшими автобусами с местами для пассажиров от 9 до 16.
Напомним, что здесь речь идет о сидячих местах. Прицеп до 750 кг также допустим.
«D1E» — для более тяжелых и больших прицепов, причем ТС в этом случае не предназначено для перевозки людей. Максимальная масса транспортного средства не должна превышать 12 тысяч килограмм.
Сегодня категории «Е» нет, зато появились такие как BE, CE, DE, C1E и D1E.
Чтобы получить ВУ с любой категорией, нужно не только пройти полный курс обучения (теория и практика) в специализированной автошколе (самоподготовка сейчас запрещена), но и сдать определенные экзамены в ГИБДД, тем самым подтвердив наличие знаний и навыков вождения. Единственное транспортное средство, для управления которого, получать права не нужно, это велосипед. Но знать ПДД все равно нужно, так как велосипед приравнивается к обычному ТС. А вот двигаться по дорогам на нем разрешено только с 14 лет. Велосипедистам младше можно ездить по тротуарам и специальным дорожкам.
Но знать ПДД все равно нужно, так как велосипед приравнивается к обычному ТС. А вот двигаться по дорогам на нем разрешено только с 14 лет. Велосипедистам младше можно ездить по тротуарам и специальным дорожкам.
Недавно стало возможным при обучении выбирать трансмиссию: автоматическую или механическую. Если вы обучились на «механике», то ездить сможете на любой коробке передач.
Но если в автошколе вы выбрали «автомат», то МКПП управлять не получится. Это запрещено, причем в правах будет стоять соответствующая отметка.
Водительское удостоверение, как и раньше, выдается на 10 лет. Лицам, которые живут на территории России и не имеют иностранных прав, российское ВУ выдается на период действия регистрации этих граждан в нашей стране.
|
Категория |
Подкатегория |
Право на управление |
Для лиц |
К экзаменам допускаются лица с |
|
— |
Мопедами и легкими квадрициклами |
Не моложе 16 лет |
16 лет |
— |
|
«А» |
— |
Мотоциклами, мотороллерами и другими мототранспортными средствами |
Не моложе 18 лет |
18 лет |
|
— |
«А1» |
Мотоциклами с рабочим объемом двигателя внутреннего сгорания, не превышающим 125 кубических сантиметров, и максимальной мощностью, не превышающей 11 киловатт |
Не моложе 16 лет |
16 лет |
|
«В» |
— |
Автомобилями (за исключением транспортных средств категории «А»), разрешенная максимальная масса которых не превышает 3500 килограммов и число сидячих мест которых, помимо сиденья водителя, не превышает восьми; автомобилями категории «В», сцепленные с прицепом, разрешенная максимальная масса которого не превышает 750 килограммов; автомобилями категории «В», сцепленными с прицепом, разрешенная максимальная масса которого превышает 750 килограммов, но не превышает массы автомобиля без нагрузки, при условии, что общая разрешенная максимальная масса такого состава транспортных средств не превышает 3500 килограммов |
Не моложе 18 лет |
17 лет |
|
— |
«В1» |
Трициклами и квадрициклами |
Не моложе 18 лет |
18 лет |
|
«ВЕ» |
— |
Автомобилями категории «В», сцепленными с прицепом, разрешенная максимальная масса которого превышает 750 килограммов и превышает массу автомобиля без нагрузки; автомобилями категории «В», сцепленными с прицепом, разрешенная максимальная масса которого превышает 750 килограммов, при условии, что общая разрешенная максимальная масса такого состава транспортных средств превышает 3500 килограммов |
Не моложе 19 лет |
19 лет + имеющие право управления транспортными средствами категории «В» не менее 12 месяцев |
|
«С» |
— |
Автомобилями, за исключением автомобилей категории «D», разрешенная максимальная масса которых превышает 3500 килограммов; автомобилями категории «С», сцепленными с прицепом, разрешенная максимальная масса которого не превышает 750 килограммов |
Не моложе 18 лет |
17 лет |
|
— |
«С1» |
Автомобилями, за исключением автомобилей категории «D», разрешенная максимальная масса которых превышает 3500 килограммов, но не превышает 7500 килограммов; автомобилями подкатегории «С1», сцепленными с прицепом, разрешенная максимальная масса которого не превышает 750 килограммов |
Не моложе 18 лет |
18 лет |
|
— |
«С1Е» |
Автомобилями подкатегории «С1», сцепленными с прицепом, разрешенная максимальная масса которого превышает 750 килограммов, но не превышает массы автомобиля без нагрузки, при условии, что общая разрешенная максимальная масса такого состава транспортных средств не превышает 12 000 килограммов |
Не моложе 19 лет |
19 лет + имеющие право управления транспортными средствами категории «С» или «С1» не менее 12 месяцев |
|
«СЕ» |
— |
Автомобилями категории «С», сцепленными с прицепом, разрешенная максимальная масса которого превышает 750 килограммов |
Не моложе 19 лет |
19 лет + имеющие право управления транспортными средствами категории «С» не менее 12 месяцев |
|
«D» |
— |
Автомобилями, предназначенными для перевозки пассажиров и имеющие более восьми сидячих мест, помимо сиденья водителя; автомобилями категории «D», сцепленными с прицепом, разрешенная максимальная масса которого не превышает 750 килограммов |
Не моложе 21 лет |
21 года |
|
«DЕ» |
— |
Автомобилями категории «D», сцепленными с прицепом, разрешенная максимальная масса которого превышает 750 килограммов; сочлененными автобусами |
Не моложе 22 лет |
22 лет + имеющие право управления транспортными средствами категории «D» не менее 12 месяцев (за исключением транспортных средств ВС РФ) |
|
— |
«D1» |
Автомобилями, предназначенными для перевозки пассажиров и имеющими более восьми, но не более шестнадцати сидячих мест, помимо сиденья водителя; автомобилями подкатегории «D1», сцепленными с прицепом, разрешенная максимальная масса которого не превышает 750 килограммов |
Не моложе 21 лет |
21 года |
|
— |
«D1Е» |
Автомобилями подкатегории «D1», сцепленными с прицепом, который не предназначен для перевозки пассажиров, разрешенная максимальная масса которого превышает 750 килограммов, но не превышает массы автомобиля без нагрузки, при условии, что общая разрешенная максимальная масса такого состава транспортных средств не превышает 12 000 килограммов |
Не моложе 22 лет |
22 лет + имеющие право управления транспортными средствами категории «D» или «D1» не менее 12 месяцев (за исключением транспортных средств ВС РФ) |
|
«Tm» |
— |
Трамваями |
Не моложе 21 лет |
21 года |
|
«Tb» |
— |
Троллейбусами |
Не моложе 21 лет |
21 года |
Видеоматериал о том, какие новые категории недавно появились:
youtube.com/embed/R1QWXoS-QsI»/>
Ездите вежливо и аккуратно!
В статье использовано изображение с сайта daeshprava.ru
Автошкола Престиж Петрозаводск
Мотоцикл Stels Flex 250
Мотоцикл Stels Flex 250 Технические характеристики: Объем двигателя: см3 225 Мощность: 15 лс Количество цилиндров: 1 Число тактов: 4 Максимальная скорость: 130 км/ч Расход бензина: 5 л/100 км Объем бака: 15 литров Коробка передач Механика: 5 передач Габариты: 740/1040/2085 мм
Daewoo Nexia
Daewoo Nexia Технические характеристики: Тип привода: передний Тормоза передние/задние: дисковые вентилируемые/барабанные Усилитель руля: гидроусилитель Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1498 Максимальная мощность, л.с: 90 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4482; ширина — 1662; высота — 1393; колесная база — 2520; клиренс — 160 Снаряженная масса, кг: 1036 Полная масса, кг: 1530
Volkswagen Polo
Volkswagen Polo Технические характеристики: Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с./кВт при об/мин: 105 / 77 при 5250 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Тип привода: передний Размеры в мм: длина — 4384; ширина — 1699; высота — 1465; колесная база — 2552; клиренс — 170 Снаряженная масса, кг: 1159 Полная масса, кг: 1660
ЗИЛ431410
ЗИЛ 431410 Технические характеристики: Тип двигателя/расположение: бензин/переднее Объем двигателя, см3: 6000 Максимальная мощность, л.с./кВт при об/мин: 150 / Количество цилиндров: 8 Коробка передач: механика Количество передач: 5 Тип привода: передний Размеры в мм: длина — 6675; ширина — 2500; высота — 2400; Снаряженная масса, кг: 4300 Полная масса, кг: 10525
Renault Logan
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с: 87 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4346; ширина — 1733; высота — 1517; колесная база — 2634; клиренс — 155 Снаряженная масса, кг: 1106 Полная масса, кг: 1545
Volkswagen Crafter
Volkswagen Crafter Технические характеристики: Тип двигателя/расположение: дизель/переднее, поперечное Объем двигателя, см3: 1968 Максимальная мощность, л.с./кВт при об/мин: 109 / 80.7 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Тип привода: передний Размеры в мм: длина — 7340; ширина — 2426; высота — 2755; колесная база — 1521; клиренс — 170 Снаряженная масса, кг: 3200 Полная масса, кг: 5000
RACER RC200LT
Объем двигателя: см3 200 Мощность: 15.37 лс Количество цилиндров: 1 Число тактов: 4 Максимальная скорость: 130 км/ч Расход бензина: 5 л/100 км Объем бака: 14 литров Коробка передач Механика: 5 передач Габариты: 2070/809/1110 мм
Foton
Тип привода: задний Тормоза передние/задние: барабанные/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: дизель/переднее, поперечное Объем двигателя, см3: 3990 Максимальная мощность, л.с: 131 Количество цилиндров: 6 Коробка передач: механика Количество передач: 6 Размеры в мм: длина — 7520; ширина — 2500; высота — 2530; колесная база — 4200 Снаряженная масса, кг: 5150 Полная масса, кг: 10700
Daewoo Nexia
Daewoo Nexia Тип привода: передний Тормоза передние/задние: дисковые вентилируемые/барабанные Усилитель руля: гидроусилитель Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1498 Максимальная мощность, л.с: 90 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4482; ширина — 1662; высота — 1393; колесная база — 2520; клиренс — 160 Снаряженная масса, кг: 1036 Полная масса, кг: 1530
Renault Logan
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с: 87 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4346; ширина — 1733; высота — 1517; колесная база — 2634; клиренс — 155 Снаряженная масса, кг: 1106 Полная масса, кг: 1545
Daewoo Nexia
Daewoo Nexia Технические характеристики: Тип привода: передний Тормоза передние/задние: дисковые вентилируемые/барабанные Усилитель руля: гидроусилитель Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1498 Максимальная мощность, л.с: 90 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4482; ширина — 1662; высота — 1393; колесная база — 2520; клиренс — 160 Снаряженная масса, кг: 1036 Полная масса, кг: 1530
CHEVROLET AVEO
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1206 Максимальная мощность, л.с: 84 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4310; ширина — 1670; высота — 1495; колесная база — 2480 Снаряженная масса, кг: 1115 Полная масса, кг: 1533
Volkswagen Polo
Volkswagen Polo Технические характеристики: Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с./кВт при об/мин: 105 / 77 при 5250 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Тип привода: передний Размеры в мм: длина — 4384; ширина — 1699; высота — 1465; колесная база — 2552; клиренс — 170 Снаряженная масса, кг: 1159 Полная масса, кг: 1660
Peugeot 207
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1360 Максимальная мощность, л.с: 73 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4030; ширина — 1748; высота — 1502; колесная база — 2540 Масса без нагрузки, кг: 1213 Полная масса, кг: 1580
Renault Logan
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с: 87 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4346; ширина — 1733; высота — 1517; колесная база — 2634; клиренс — 155 Снаряженная масса, кг: 1106 Полная масса, кг: 1545
Daewoo Nexia
Daewoo Nexia Технические характеристики: Тип привода: передний Тормоза передние/задние: дисковые вентилируемые/барабанные Усилитель руля: гидроусилитель Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1498 Максимальная мощность, л.с: 90 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4482; ширина — 1662; высота — 1393; колесная база — 2520; клиренс — 160 Снаряженная масса, кг: 1036 Полная масса, кг: 1530
Skoda Fabia
Skoda Fabia Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: электрогидровлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1198 Максимальная мощность, л.с: 69 Количество цилиндров: 3 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4000; ширина — 1642; высота — 1498; колесная база — 2465; клиренс — 149 Снаряженная масса, кг: 1095 Полная масса, кг: 1550
Daewoo Nexia
Технические характеристики: Тип привода: передний Тормоза передние/задние: дисковые вентилируемые/барабанные Усилитель руля: гидроусилитель Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1498 Максимальная мощность, л.с: 90 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4482; ширина — 1662; высота — 1393; колесная база — 2520; клиренс — 160 Снаряженная масса, кг: 1036 Полная масса, кг: 1530
Volkswagen Polo
Volkswagen Polo Технические характеристики: Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с./кВт при об/мин: 105 / 77 при 5250 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Тип привода: передний Размеры в мм: длина — 4384; ширина — 1699; высота — 1465; колесная база — 2552; клиренс — 170 Снаряженная масса, кг: 1159 Полная масса, кг: 1660
Прицеп к грузовому автомобилю
Прицеп к грузовому автомобилю Прицеп бортовой с поворотным устройством Полезная грузоподъемность, кг – 2500 Подвеска: независимая, рессорная Полна масса, кг – 4120 Оси/колеса: 2/4 Габаритные размеры автомобиля с кузовом, мм: длина — 6500; ширина — 2400; высота — 3200
Chevrolet Lacetti
Chevrolet Lacetti Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидровлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1399 Максимальная мощность, л.с: 95 Количество цилиндров: 4 Коробка передач: автомат Количество передач: 5 Размеры в мм: длина — 4295; ширина — 1725; высота — 1445; колесная база — 2600; клиренс — 145 Снаряженная масса, кг: 1170 Полная масса, кг: 1650
УАЗ 31514
Тип привода: полный, подключаемый Тормоза передние/задние: барабанные/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/продольное Объем двигателя, см3: 2450 Максимальная мощность, л.с: 76 Количество цилиндров: 4 Коробка передач: механика Количество передач: 4 Размеры в мм: длина — 4025; ширина — 1785; высота — 2020; колесная база — 2380; клиренс — 220 Снаряженная масса, кг: 1750 Полная масса, кг: 2500
Skoda Fabia
Skoda Fabia Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: электрогидровлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1198 Максимальная мощность, л.с: 69 Количество цилиндров: 3 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4000; ширина — 1642; высота — 1498; колесная база — 2465; клиренс — 149 Снаряженная масса, кг: 1095 Полная масса, кг: 1550
Volkswagen Crafter
Volkswagen Crafter Технические характеристики: Тип двигателя/расположение: дизель/переднее, поперечное Объем двигателя, см3: 1968 Максимальная мощность, л.с./кВт при об/мин: 109 / 80.7 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Тип привода: передний Размеры в мм: длина — 7340; ширина — 2426; высота — 2755; колесная база — 1521; клиренс — 170 Снаряженная масса, кг: 3200 Полная масса, кг: 5000
ЗИЛ-431410
Тип привода: задний Тормоза передние/задние: барабанные/барабанные Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 6000 Максимальная мощность, л.с: 150 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 6675 ширина — 2500; высота — 2400; Снаряженная масса, кг: 4175 Полная масса, кг: 10400
Renault Logan
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с: 87 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4346; ширина — 1733; высота — 1517; колесная база — 2634; клиренс — 155 Снаряженная масса, кг: 1106 Полная масса, кг: 1545
Chevrolet Lanos
Chevrolet Lanos Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидровлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1498 Максимальная мощность, л.с: 86 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4237; ширина — 1678; высота — 1432; колесная база — 1405; клиренс — 160 Снаряженная масса, кг: 1111 Полная масса, кг: 1595
Renault Logan
Тип привода: передний Тормоза передние/задние: дисковые/барабанные Усилитель руля: гидравлический Тип двигателя/расположение: бензин/переднее, поперечное Объем двигателя, см3: 1598 Максимальная мощность, л.с: 87 Количество цилиндров: 4 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 4346; ширина — 1733; высота — 1517; колесная база — 2634; клиренс — 155 Снаряженная масса, кг: 1106 Полная масса, кг: 1545
Прицеп к легковому автомобилю
Прицеп к легковому автомобилю Масса перевозимого груза, кг: 1350 Масса снаряженного прицепа, кг: 450 Максимальная полная масса прицепа, кг: 1800 Габаритные размеры, мм: длина — 6460; ширина — 2205; Подвеска: независимая, резиножгутовая Стояночная тормозная системаесть Количество осей/колес: 2/4
Мопед Orion 50B
Технические характеристики: Двигатель: 4х-тактный, 1-цилиндровый, воздушного охлаждения; 49,0 куб.см Максимальная мощность, л.с. (об.м.): 3,8 (7000) Максимальный крутящий момент, Нм (об.м.): 3,1 (5000) Система питания: карбюраторная, бензин с октановым числом не ниже 92 Трансмиссия: механическая КПП, 4 передачи (1-N-2-3-4) Сцепление: многодисковое, в масляной ванне Главная передача: цепь роликовая с приводом на заднее колесо Система запуска: электростартер, кик-стартер
Автобус ПАЗ 4230-01 «Аврора»
Автобус ПАЗ 4230-01 «Аврора» Тип привода: задний Тормоза передние/задние: барабанные/барабанные Тип двигателя/расположение: дизель/переднее Объем двигателя, см3: 4750 Максимальная мощность, л.с: 136 Количество цилиндров: 8 Коробка передач: механика Количество передач: 5 Размеры в мм: длина — 8380; ширина — 2 500; высота — 2 995; колесная база — 2094 Снаряженная масса, кг: 7070 Полная масса, кг: 11040 Количество пассажирских мест для сидения: 31 Пассажировместимость полная: 54
Закон — ГКПЧ
Фото: Джейкоб Эйдингер
Закон о правах человека города Нью-Йорка (раздел 8 Административного кодекса города Нью-Йорка) запрещает дискриминацию в городе Нью-Йорк при приеме на работу, жилье и общественные места. Защищенные классы в этих областях указаны ниже. Закон о правах человека города Нью-Йорка также защищает от дискриминационной практики кредитования, репрессалий, дискриминационных преследований и предвзятого профилирования со стороны правоохранительных органов.
Жалоба должна быть подана в Комиссию в течение одного года с момента последнего предполагаемого акта дискриминации (или трех лет для дел, связанных с домогательствами по признаку пола). Предполагаемый акт дискриминации должен иметь место в пределах города Нью-Йорка или иметь достаточную связь с ним, чтобы жалоба была подана в Комиссию.
Классы, защищенные законом о правах человека:
Дополнительная защита при приеме на работу:
Дополнительные классы защиты в корпусе:
Возмездие
Противозаконно любое лицо — ваш работодатель, домовладелец или любое другое лицо, к которому применяется Закон о правах человека города Нью-Йорка, — принимать меры против вас, потому что вы:
- Выступил против незаконной дискриминационной практики
- Обвинение или подача жалобы о дискриминации в Комиссию по правам человека г. Нью-Йорка, вашего работодателя или любое другое агентство.
- Свидетельствовал, помогал или участвовал в расследовании, судебном разбирательстве или слушании в отношении чего-либо, запрещенного Законом Нью-Йорка о правах человека.
Закон защищает вас от репрессалий, если у вас есть разумное добросовестное убеждение в том, что поведение людей является незаконным, даже если окажется, что вы ошибались.
Защита занятости в соответствии с Законом о правах человека
Закон о правах человека города Нью-Йорка запрещает дискриминацию в:- Наем, в том числе в объявлениях о вакансиях и собеседованиях
- Заработная плата и пособия
- Оценка эффективности
- Повышения и понижения
- Дисциплина и увольнение
- Любые решения, влияющие на условия найма
Разумные приспособления к работе
При приеме на работу разумное приспособление — это изменение графика работы или обязанностей сотрудника с целью приспособления его к конкретным потребностям и предоставления им возможности выполнять свою работу.Работодатель должен предоставить разумные приспособления, если это не создаст чрезмерные трудности для работодателя, для следующих защищенных классов:
- Инвалидность: Работодатели должны делать разумные приспособления для удовлетворения потребностей лиц с физическими, медицинскими, умственными или психологическими нарушениями либо с историей или записями о таких нарушениях.
- Беременность, роды или связанное с ними заболевание: Работодатели должны делать разумные приспособления к людям на основании их беременности, родов, восстановления после родов или состояния здоровья, связанного с их беременностью или родами.
- Соблюдение религиозных норм: Работодатели должны принимать разумные меры для удовлетворения религиозных потребностей сотрудников и кандидатов на работу, включая соблюдение субботы и других святых дней.
- Статус жертвы домашнего насилия, сексуального насилия или преследований: работодатели должны делать разумные приспособления к потребностям лиц, которые подвергались или подвергались определенным действиям или угрозам насилия.
- Лактация: Работодатели должны предоставить сотрудникам помещения для кормления грудью, включая комнату для кормления, где сотрудники могут сцеживать / сцеживать грудное молоко, и разумное время для сцеживания / сцеживания грудного молока.
Защита жилья в соответствии с Законом о правах человека
Закон о правах человека города Нью-Йорка запрещает дискриминацию в:
- Аренда и продажа, в том числе в рекламе и интервью
- Аренда и продажа, включая условия и привилегии
- Направление людей в определенные районы или от них
- Ипотека и кредиты, в том числе на условиях
- Любые решения, влияющие на условия вашего жилья
Разумное жилище
В сфере жилья разумное приспособление — это изменение условий, условий или привилегий жилого помещения с учетом фактической или потенциальной инвалидности жителя.Поставщик жилья должен предоставить и оплатить разумные приспособления, если это не создаст неоправданных трудностей.
Защита общественных помещений в соответствии с Законом о правах человека
Закон о правах человека города Нью-Йорка запрещает дискриминацию в общественных местах, таких как рестораны, магазины, больницы, музеи и театры, среди прочего.
Разумное размещение в общественных местах
Разумное приспособление — это изменение, внесенное в среду, условия или привилегии общественного помещения для размещения покровителя или клиента с ограниченными возможностями.Поставщик общественных помещений должен предоставлять и оплачивать разумные приспособления, если это не создаст неоправданных трудностей.
17 Кодекс США § 107 — Ограничения исключительных прав: Добросовестное использование | Кодекс США | Закон США
Исторические и редакционные заметки
дом отчет нет. 94–1476Общие сведения о проблеме. Судебная доктрина добросовестного использования, одно из наиболее важных и устоявшихся ограничений исключительного права владельцев авторских прав, впервые получит прямое законодательное признание в разделе 107.Утверждение о том, что действия ответчика представляют собой добросовестное использование, а не нарушение, было выдвинуто в качестве защиты в бесчисленных судебных исках о нарушении авторских прав на протяжении многих лет, и существует обширная прецедентная практика, признающая существование доктрины и ее применение. Примеры, перечисленные на странице 24 Отчета Регистра за 1961 год, хотя и не являются исчерпывающими, но дают некоторое представление о том, какой вид деятельности суды могут рассматривать как добросовестное использование в данных обстоятельствах:
«цитирование выдержек из обзора или критика для целей. иллюстрации или комментария; цитата из коротких отрывков из научной или технической работы для иллюстрации или пояснения авторских наблюдений; использование в пародии части содержания пародируемого произведения; краткое изложение обращения или статьи с краткими цитатами в новостном репортаже; воспроизведение библиотекой части произведения для замены части поврежденной копии; воспроизведение учителем или учеником небольшой части произведения для иллюстрации урока; воспроизведение произведения в законодательных или судебных процессах или отчетах; случайное и случайное воспроизведение в кинохронике или радиопередаче произведения, находящегося на месте репортажа о событии.”
Хотя суды неоднократно рассматривали и выносили решения по доктрине добросовестного использования, никакого реального определения этой концепции так и не появилось. В самом деле, поскольку доктрина представляет собой справедливое правило разума, невозможно вообще применимое определение, и каждый случай, поднимающий вопрос, должен решаться на основе собственных фактов. С другой стороны, суды разработали набор критериев, которые, хотя ни в коем случае не являются окончательными или определяющими, обеспечивают некоторый критерий для уравновешивания акций. Эти критерии были сформулированы по-разному, но по существу все они могут быть сведены к четырем стандартам, принятым в разделе 107: «(1) цель и характер использования, включая то, имеет ли такое использование коммерческий характер или предназначен для некоммерческих образовательных целей; (2) характер работы, защищенной авторским правом; (3) количество и существенность части, используемой по отношению к работе, защищенной авторским правом, в целом; и (4) влияние использования на потенциальный рынок или стоимость работы, защищенной авторским правом.”
Эти критерии имеют отношение к определению того, применяется ли основная доктрина добросовестного использования, как указано в первом предложении раздела 107, в конкретном случае: «Несмотря на положения статьи 106, добросовестное использование произведения, защищенного авторским правом, включая такое использование путем воспроизведения в копиях или на фонограммах или любыми другими способами, указанными в этом разделе, для таких целей, как критика, комментарии, репортажи, обучение (включая множественные копии для использования в классе), стипендии или исследования, не является нарушением авторских прав.”
Конкретная формулировка раздела 107 в его нынешнем виде является результатом процесса наращивания, возникшего в результате долгих споров по связанным проблемам добросовестного использования и воспроизведения (в основном путем фотокопирования) материалов, защищенных авторским правом, в образовательных и научных целях. Например, ссылка на добросовестное использование «путем воспроизведения в копиях или на фонограммах или любыми другими средствами» в основном предназначена для того, чтобы прояснить, что доктрина имеет такое же применение к фотокопированию и записи на пленку, как и к более старым формам использования; оно не предназначено для придания такого рода воспроизведению какого-либо особого статуса в соответствии с положением о добросовестном использовании или для санкционирования любого воспроизведения, выходящего за рамки нормальных и разумных пределов добросовестного использования.Точно так же недавно добавленная ссылка на «несколько копий для использования в классе» является признанием того, что при надлежащих обстоятельствах справедливости доктрина может применяться к воспроизведению нескольких копий для членов класса.
Комитет внес поправки в первый из рассматриваемых критериев — «цель и характер использования» — чтобы прямо указать, что этот фактор включает рассмотрение того, «имеет ли такое использование коммерческий характер или для некоммерческих образовательных целей. целей.Эта поправка не предназначена для интерпретации как некоммерческое ограничение использования произведений, защищенных авторским правом, в образовательных целях. Это явное признание того, что, как и в соответствии с действующим законодательством, коммерческий или некоммерческий характер деятельности, хотя и не является решающим в отношении добросовестного использования, может и должен учитываться вместе с другими факторами при принятии решений о добросовестном использовании.
Общее намерение за положением. Заявление о доктрине добросовестного использования в разделе 107 предлагает пользователям некоторые рекомендации по определению того, когда применяются принципы этой доктрины.Однако бесконечное разнообразие ситуаций и комбинаций обстоятельств, которые могут возникнуть в конкретных случаях, не позволяет сформулировать точные правила в уставе. Законопроект одобряет цель и общий объем судебной доктрины добросовестного использования, но нет намерения заморозить эту доктрину в уставе, особенно в период быстрых технологических изменений. Помимо очень широкого законодательного объяснения того, что такое добросовестное использование и некоторых применимых к нему критериев, суды должны иметь право адаптировать доктрину к конкретным ситуациям в каждом конкретном случае.Раздел 107 призван заново сформулировать существующую судебную доктрину добросовестного использования, а не изменять, сужать или расширять ее каким-либо образом.
Намерение относительно репродукции в классе. Хотя произведения и способы использования, к которым применима доктрина добросовестного использования, столь же широки, как и сам закон об авторском праве, большая часть обсуждения раздела 107 сосредоточена вокруг вопросов воспроизведения в классе, особенно фотокопирования. Аргументы по этому вопросу кратко изложены на стр. 30–31 доклада Комитета 1967 г. (H.R. Rep. No. 83, 90th Cong., 1st Sess.), И за прошедшие годы существенно не изменились.
Комитет также придерживается своего более раннего вывода о том, что «конкретное исключение, освобождающее определенные репродукции произведений, охраняемых авторским правом, в образовательных и научных целях от авторского права, не является оправданным». В то же время Комитет, как и в 1967 году, признает, что существует «потребность в большей уверенности и защите учителей». Стремясь удовлетворить эту потребность, Комитет не только принял дополнительные поправки к разделу 107, но также внес поправки в раздел 504 (c), чтобы обеспечить невиновным учителям и другим некоммерческим пользователям материалов, защищенных авторским правом, широкую защиту от необоснованной ответственности за нарушение.Последние поправки обсуждаются ниже в связи с главой 5 законопроекта [§501 et seq. этого названия].
В 1967 году Комитет также попытался подойти к этой проблеме, включив в свой отчет очень тщательное обсуждение «соображений, лежащих в основе четырех критериев, перечисленных в измененном разделе 107, в контексте типичных ситуаций в классе, возникающих сегодня». Это обсуждение появилось на стр. 32–35 отчета 1967 г. и с некоторыми изменениями было сохранено в отчете Сената по делу С.22 (S. Rep. № 94–473, стр. 63–65). Комитет рассмотрел это обсуждение и считает, что оно все еще имеет ценность для анализа различных аспектов проблемы.
На слушаниях в судебном подкомитете в июне 1975 года председатель Кастенмайер и другие члены призвали стороны встретиться независимо друг от друга, чтобы достичь согласия в отношении допустимого использования материалов, защищенных авторским правом, в образовательных целях. Реакция на эти предложения была положительной, и с сентября 1975 года было проведено несколько встреч трех групп, которые занимались, соответственно, воспроизведением в классе печатных материалов, музыки и аудиовизуальных материалов.
В совместном письме председателю Кастенмайеру от 19 марта 1976 г. представители Специального комитета учебных заведений и организаций по пересмотру законодательства об авторском праве, Лиги авторов Америки, Inc. и Ассоциации американских издателей, Inc., заявлено:
Возможно, вы помните, что в нашем письме от 8 марта 1976 г. мы сообщали вам, что переговорные группы, представляющие авторов и издателей, и Специальная группа достигли предварительного соглашения по руководящим принципам для включения в Отчет Комитета, охватывающего копирование в образовательных целях из книг и периодических изданий в соответствии с Разделом 107 из H.R. 2223 и S. 22 [этот раздел], и что в рамках этого предварительного соглашения каждая сторона примет поправки к Разделам 107 и 504 [этот раздел и раздел 504 этого заголовка], которые были приняты вашим Подкомитетом 3 марта. , 1976.
Теперь мы рады сообщить вам, что соглашение было одобрено руководителями, и мы прилагаем копию к настоящему документу. Первоначально мы намеревались перевести соглашение на язык, подходящий для включения в законодательный отчет, касающийся раздела 107 [этот раздел], но с тех пор сотрудники комитета сообщили нам, что в этом нет необходимости.
Как указано выше, соглашение относится только к копированию книг и периодических изданий и не предназначено для применения к музыкальным или аудиовизуальным произведениям.
Полный текст договора следующий:
Соглашение о руководящих принципах копирования в классе в некоммерческих учебных заведениях
в отношении книг и периодических изданийЦелью следующих руководств является установление минимальных, а не максимальных стандартов добросовестного использования в образовательных целях в соответствии с разделом 107 H.Р. 2223 [этот раздел]. Стороны соглашаются, что условия, определяющие степень допустимого копирования в образовательных целях, могут измениться в будущем; что определенные типы копирования, разрешенные в соответствии с этими руководящими принципами, могут быть запрещены в будущем; и наоборот, что в будущем другие типы копирования, не разрешенные в соответствии с этими руководящими принципами, могут быть разрешены в соответствии с пересмотренными руководящими принципами.
Более того, нижеследующее изложение руководящих принципов не предназначено для ограничения типов копирования, разрешенных в соответствии со стандартами добросовестного использования в соответствии с судебным решением и которые указаны в Разделе 107 Закона о пересмотре авторских прав [этот раздел].Могут быть случаи, когда копирование, не подпадающее под указанные ниже руководящие принципы, тем не менее может быть разрешено в соответствии с критериями добросовестного использования.
руководящие указанияI. Единичное копирование для учителей
Одна копия может быть сделана учителем или для него по его или ее индивидуальному запросу для его или ее научного исследования или использования в обучении или подготовке к ведению класса:
A. Глава из книги;
B. Статья из журнала или газеты;
С.Короткий рассказ, короткое эссе или короткое стихотворение, независимо от того, принадлежит ли оно коллективному произведению;
D. График, график, диаграмма, рисунок, карикатура или изображение из книги, журнала или газеты;
II. Несколько копий для использования в классе
Множественные копии (в любом случае не более одной копии на ученика в курсе) могут быть сделаны учителем или для преподавателя курса для использования в классе или обсуждения; при условии, что:
A. Копирование соответствует критериям краткости и спонтанности, как определено ниже; и,
Б.Соответствует тесту на совокупный эффект, как определено ниже; и
C. Каждая копия включает уведомление об авторских правах.
Определения
Краткость
(i) Поэзия: (а) полное стихотворение, если оно содержит менее 250 слов и если напечатано не более чем на двух страницах, или (б) отрывок из более длинного стихотворения, состоящий не более чем из 250 слов.
(ii) Проза: (а) либо полная статья, рассказ или эссе объемом менее 2500 слов, либо (б) отрывок из любого прозаического произведения объемом не более 1000 слов или 10% произведения, в зависимости от того, что меньше, но в любом случае минимум 500 слов.
[Каждый из числовых ограничений, указанных в пунктах «i» и «ii» выше, может быть расширен, чтобы разрешить завершение незаконченной строки стихотворения или незаконченного абзаца прозы.]
(iii) Иллюстрация: одна диаграмма, график, диаграмма, рисунок, карикатура или рисунок на книгу или периодическое издание.
(iv) «Особые» произведения: некоторые произведения в поэзии, прозе или «поэтической прозе», которые часто сочетают язык с иллюстрациями и которые предназначены иногда для детей, а в других случаях для более широкой аудитории, не содержат 2500 слов. целостность.Параграф «ii» выше, несмотря на то, что такие «особые произведения» не могут быть воспроизведены полностью; однако отрывок, состоящий не более чем из двух опубликованных страниц такого специального произведения и содержащий не более 10% слов, найденных в его тексте, может быть воспроизведен.
Спонтанность
(i) Копирование осуществляется по просьбе и вдохновению отдельного учителя, и
(ii) Вдохновение и решение использовать произведение, а также момент его использования для максимальной эффективности обучения настолько близки по времени, что было бы неразумно ожидать своевременного ответа на запрос о разрешении.
Суммарный эффект
(i) Копирование материала предназначено только для одного курса в школе, в которой сделаны копии.
(ii) Не более одного короткого стихотворения, статьи, рассказа, эссе или двух отрывков могут быть скопированы от одного и того же автора, или более трех из одного коллективного произведения или периодического издания в течение одного семестра.
(iii) Не должно быть более девяти экземпляров такого многократного копирования для одного курса в течение одного семестра.
[Ограничения, указанные в пунктах «ii» и «iii» выше, не применяются к текущим периодическим новостным изданиям и газетам, а также к разделам текущих новостей других периодических изданий.]
III. Запреты на I и II Свыше
Несмотря на все вышеперечисленное, запрещается следующее:
(A) Копирование не должно использоваться для создания, замены или замены антологий, компиляций или коллективных произведений. Такая замена или замена может иметь место независимо от того, накапливаются или воспроизводятся и используются копии различных произведений или отрывков из них.
(B) Запрещается копирование произведений или произведений, предназначенных для использования в качестве «расходных материалов» в процессе обучения или преподавания.Сюда входят рабочие тетради, упражнения, стандартизированные тесты, тестовые буклеты, листы с ответами и подобные расходные материалы.
(C) Копирование запрещено:
(а) заменяет покупку книг, оттисков издательств или периодических изданий;
(b) руководствуется вышестоящей инстанцией;
(c) повторяется по отношению к одному и тому же заданию одним и тем же учителем из триместра в триместр.
(D) С учащегося не взимается никакая дополнительная плата, кроме фактической стоимости ксерокопирования.
Согласовано 19 марта 1976 г.
Специальный комитет по пересмотру Закона об авторском праве:
Автор: Шелдон Эллиот Штайнбах.
Авторско-издательская группа:
Лига авторов Америки:
Ассоциация американских издателей, Inc .:
Александр К. Хоффман.
Председатель Комитета по авторскому праву.
В совместном письме от 30 апреля 1976 г. представители Ассоциации музыкальных издателей США, Inc., Национальной ассоциации музыкальных издателей, Inc., Национальная ассоциация учителей музыки, Национальная конференция музыкальных педагогов, Национальная ассоциация музыкальных школ и Специальный комитет по пересмотру закона об авторском праве написали Председателю Кастенмайеру следующее:
Во время слушаний по HR 2223 в июне 1975 года вы и несколько членов вашего подкомитета предложили заинтересованным группам работать вместе над разработкой руководящих принципов, которые были бы полезны для разъяснения Раздела 107 законопроекта [этот раздел].
Представители музыкальных педагогов и музыкальных издателей отложили свои встречи до тех пор, пока не будут разработаны руководящие принципы в отношении книг и периодических изданий.Вскоре после того, как эта работа была завершена и эти руководящие принципы были переданы вашему подкомитету, представители нижеподписавшихся музыкальных организаций встретились вместе с представителями Специального комитета по пересмотру закона об авторском праве, чтобы разработать руководящие принципы, касающиеся музыки.
Нам очень приятно сообщить вам, что обсуждение разработанных руководящих принципов было плодотворным. Поскольку частные учителя музыки являются важным фактором в музыкальном образовании, должное внимание было уделено проблемам этой группы.
Мы надеемся, что это поможет в отчете по законопроекту прояснить добросовестное использование применительно к музыке.
Текст инструкции, прилагаемой к этому письму, выглядит следующим образом:
руководство по использованию музыки в образовательных целяхЦелью следующих руководств является установление минимальных, а не максимальных стандартов добросовестного использования в образовательных целях в соответствии с разделом 107 Закона № 2223 [этот раздел]. Стороны соглашаются, что условия, определяющие степень допустимого копирования в образовательных целях, могут измениться в будущем; что определенные типы копирования, разрешенные в соответствии с этими рекомендациями, могут быть недопустимыми в будущем, и, наоборот, что в будущем другие типы копирования, не разрешенные в соответствии с этими правилами, могут быть разрешены в соответствии с пересмотренными правилами.
Более того, нижеследующее изложение руководящих принципов не предназначено для ограничения типов копирования, разрешенных в соответствии со стандартами добросовестного использования в соответствии с судебным решением и которые указаны в Разделе 107 Закона о пересмотре авторских прав [этот раздел]. Могут быть случаи, когда копирование, не подпадающее под указанные ниже руководящие принципы, тем не менее может быть разрешено в соответствии с критериями добросовестного использования.
A. Допустимое использование
1. Экстренное копирование для замены купленных копий, которые по какой-либо причине недоступны для немедленного исполнения, при условии, что купленные заменяющие копии будут заменены в надлежащее время.
2. (a) Для академических целей, отличных от исполнения, могут быть сделаны несколько копий отрывков произведений, при условии, что отрывки не составляют часть целого, составляющую исполняемую единицу, такую как отрывок, движение или ария, но ни в коем случае не более 10% всей работы. Тираж не может превышать одного экземпляра на ученика.
(b) Для академических целей, кроме выступления, — единственная копия всего исполняемого элемента (раздела, движения, арии и т. Д.).) то есть (1) подтверждено правообладателем, что оно не издается или (2) недоступно, за исключением более крупной работы, может быть сделано учителем или для учителя исключительно с целью его или ее научного исследования или в рамках подготовки к учите класс.
3. Приобретенные печатные копии могут быть отредактированы или упрощены при условии, что основной характер произведения не будет искажен, или текст, если таковой имеется, изменен или текст добавлен, если таковой не существует.
4. Единственная копия записей выступлений студентов может быть сделана для оценки или репетиций и может быть сохранена учебным заведением или отдельным преподавателем.
5. Одна копия звукозаписи (например, кассеты, диска или кассеты) музыки, защищенной авторским правом, может быть сделана из звукозаписей, принадлежащих образовательному учреждению или отдельному учителю с целью построения упражнений на слух или экзаменов, и может быть сохраняется за учебным заведением или индивидуальным преподавателем. (Это относится только к авторским правам на саму музыку, а не к каким-либо авторским правам, которые могут существовать в отношении звукозаписи.)
B. Запреты
1.Копирование для создания или замены антологий, сборников или коллективных произведений.
2. Копирование или копирование произведений, предназначенных для использования в процессе обучения или преподавания, таких как рабочие тетради, упражнения, стандартизированные тесты, листы для ответов и тому подобное.
3. Копирование для служебных целей, за исключением пункта A (1) выше.
4. Копирование с целью замены покупки музыки, за исключением пунктов A (1) и A (2) выше.
5.Копирование без включения уведомления об авторских правах, которое появляется на распечатанной копии.
Проблему записи аудиовизуальных произведений, защищенных авторским правом, включенных в радио- и телепередачи, для некоммерческих учебных аудиторий оказалось трудно решить. Комитет считает, что доктрина добросовестного использования имеет ограниченное применение в этой области, но похоже, что разработка подробных руководящих принципов потребует более тщательного изучения потребностей и проблем ряда различных затронутых интересов, чем это было возможно до сих пор. и о различных представленных правовых проблемах.Ничто в разделе 107 или другом месте законопроекта не предназначено для изменения или предубеждения закона по данному вопросу. С другой стороны, Комитет понимает важность проблемы и настоятельно призывает представителей различных интересов, если возможно, под руководством Регистра авторских прав, продолжить свои обсуждения активно и в конструктивном духе. Если это будет полезно для решения, Комитет готов предпринять дальнейшее рассмотрение проблемы на следующем Конгрессе.
Комитет ценит и одобряет усилия и дух сотрудничества и разумный дух сторон, которые достигли согласованных руководящих принципов в отношении книг, периодических изданий и музыки. Представители Американской ассоциации университетских профессоров и Ассоциации американских юридических школ написали в Комитет письма, в которых резко критикуют руководящие принципы, особенно в отношении множественного копирования, как слишком ограничительные в отношении ситуаций в классе в университете и на уровне выпускников.Однако Комитет отмечает, что в Специальную группу действительно входили представители высшего образования, что заявленная «цель * * * руководящих принципов состоит в том, чтобы установить минимальные, а не максимальные стандарты добросовестного использования в образовательных целях» и что в соглашении признается, что «там могут быть случаи, когда копирование, не подпадающее под правила * * *, тем не менее может быть разрешено в соответствии с критериями добросовестного использования ».
Комитет считает, что данное руководство является разумной интерпретацией минимальных стандартов добросовестного использования.Учителя будут знать, что копирование в рамках руководящих принципов является добросовестным использованием. Таким образом, руководящие принципы служат для удовлетворения потребности в большей уверенности и защите учителей. Комитет выражает надежду на то, что если есть области, в которых могут быть уместны стандарты, отличные от этих руководящих принципов, стороны будут продолжать свои усилия по предоставлению дополнительных конкретных руководящих принципов в том же духе доброй воли и взаимных уступок, которыми отмечалось обсуждение этого вопроса. в последние месяцы.
Копирование и использование в других целях. Концентрированное внимание, уделяемое положению о добросовестном использовании в контексте учебной деятельности, не должно препятствовать его применению в других областях. Следует еще раз подчеркнуть, что одни и те же общие стандарты добросовестного использования применимы ко всем видам использования материалов, защищенных авторским правом, хотя относительный вес, который им следует придавать, будет отличаться от случая к случаю.
Доктрина добросовестного использования будет иметь отношение к использованию отрывков из произведений, охраняемых авторским правом, в образовательной вещательной деятельности, не исключенной в соответствии с разделом 110 (2) или 112, и не подпадающей под действие положений о лицензировании раздела 118.В этих случаях факторы, которые необходимо взвесить при применении критериев этого раздела, будут включать в себя оплату исполнителей, продюсеров, режиссеров и других лиц, ответственных за трансляцию, размер и характер аудитории, размер и количество взятых отрывков и в случае записей, сделанных для трансляции, количество воспроизведенных копий и степень их повторного использования или обмена. Доступность доктрины добросовестного использования для образовательных вещательных компаний была бы узко ограничена в случае кинофильмов и других аудиовизуальных произведений, но при соответствующих обстоятельствах она могла бы применяться к непоследовательному показу отдельного кадра или слайда или к исполнению короткометражного фильма. отрывок из фильма для критики или комментария.
Другой особый случай, иллюстрирующий применение доктрины добросовестного использования, относится к изготовлению копий или фонограмм произведений в специальных формах, необходимых для использования слепыми. Эти специальные формы, такие как копии с использованием шрифта Брайля и фонограммы устных чтений (говорящие книги), обычно не производятся издателями для коммерческого распространения. По большей части такие копии и фонограммы изготавливаются Отделом по делам слепых и инвалидов Библиотеки Конгресса с разрешения, полученного от владельцев авторских прав, и распространяются среди слепых через региональные библиотеки по всей стране.Кроме того, такие копии и фонограммы изготавливаются на месте отдельными добровольцами для использования слепыми людьми в их общинах, а Библиотека Конгресса проводит программу обучения таких добровольцев. В то время как изготовление нескольких копий или фонограмм произведения для общего распространения требует разрешения правообладателя, проблема решена в разделе 710 законопроекта, изготовление одной копии или фонограммы отдельным лицом в качестве бесплатной услуги для слепых. будет надлежащим образом считаться добросовестным использованием в соответствии с разделом 107.
Особую актуальность представляет проблема сохранения для потомков оттисков фильмов, снятых до 1942 года. Помимо прискорбного факта, что в очень многих случаях единственная существующая копия фильма была преднамеренно уничтожена, оставшиеся находятся в непосредственной опасности. распада; они были напечатаны на пленке с нитратной основой, которая со временем неизбежно разлагается. Следует приветствовать усилия Библиотеки Конгресса, Американского института кино и других организаций по спасению и сохранению этого незаменимого вклада в нашу культурную жизнь, а изготовление дубликатов для целей архивного хранения, безусловно, относится к сфере « добросовестное использование.”
Если работа, защищенная авторским правом, содержит несправедливую, неточную или уничижительную информацию о человеке или учреждении, это лицо или учреждение может копировать и воспроизводить такие части работы, которые необходимы для обеспечения понятных комментариев к заявлениям, сделанным в работе.
Комитет рассмотрел вопрос о публикации на слушаниях и в документах Конгресса материалов, защищенных авторским правом. Если объем опубликованной работы или отрывка и количество разрешенных копий являются разумными в данных обстоятельствах, а сама работа имеет прямое отношение к вопросу, вызывающему законное беспокойство, Комитет считает, что публикация будет представлять собой добросовестное использование.
Во время рассмотрения законопроекта о пересмотре на 94-м Конгрессе было предложено, чтобы независимые информационные бюллетени, в отличие от внутренних органов и рекламных или рекламных публикаций, рассматривались отдельно. Утверждается, что информационные бюллетени особенно уязвимы для массового фотокопирования и что большинство информационных бюллетеней имеют довольно скромные тиражи. Независимо от того, является ли копирование частей информационного бюллетеня актом нарушения или добросовестного использования, обязательно будет зависеть от фактов конкретного дела.Однако в качестве общего принципа кажется очевидным, что объем доктрины добросовестного использования должен быть значительно уже в случае информационных бюллетеней, чем в случае периодических изданий массового тиража или научных журналов. В таких случаях важным фактором является коммерческий характер пользователя: копирование коммерческим пользователем даже небольшой части информационного бюллетеня может иметь значительное влияние на коммерческий рынок работы.
Комитет изучил использование отрывков из произведений, охраняемых авторским правом, в художественных произведениях каллиграфов.Комитет считает, что воспроизведение отрывка из защищенной авторским правом работы каллиграфа в единственном экземпляре для одного клиента не является нарушением авторских прав. Точно так же однократное воспроизведение отрывков из работы, защищенной авторским правом, студентом-каллиграфом или учителем в учебной ситуации было бы справедливым использованием работы, защищенной авторским правом.
Реестр авторских прав рекомендовал, чтобы в отчете комитета описывалась взаимосвязь между этим разделом и положениями раздела 108, касающегося воспроизведения в библиотеках и архивах.Доктрина добросовестного использования применяется к библиотечному фотокопированию, и ничто, содержащееся в разделе 108, «никоим образом не влияет на право добросовестного использования». Никакое положение раздела 108 не предназначено для лишения каких-либо прав, существующих в соответствии с доктриной добросовестного использования. Напротив, раздел 108 разрешает определенные методы ксерокопирования, которые не могут считаться добросовестным использованием.
Критерии добросовестного использования обязательно изложены в общих чертах. При применении критериев добросовестного использования к конкретным методам фотокопирования в библиотеках целью этого законодательства является обеспечение надлежащего баланса между правами создателей и потребностями пользователей.
От редакции
Поправки1992 — Pub. L. 102–492 добавлен в конце «Тот факт, что произведение не опубликовано, сам по себе не препятствует установлению добросовестного использования, если такой вывод сделан с учетом всех вышеперечисленных факторов».
1990 — Pub. L. 101–650 заменил «разделы 106 и 106A» на «раздел 106» во вводных положениях.
Обязательства и связанные с ними дочерние компании
УВКПЧ | Что такое права человека
Что такое права человека?
Права человека — это права, которые у нас есть просто потому, что мы существуем как люди, — они не предоставляются никаким государством.Эти универсальные права присуще всем нам, независимо от национальности, пола, национального или этнического происхождения, цвета кожи, религии, языка или любого другого статуса. Они варьируются от самых основных — права на жизнь — до тех, которые делают жизнь стоящей, например, права на питание, образование, работу, здоровье и свободу.
Всеобщая декларация прав человека (ВДПЧ), , принятая Генеральной Ассамблеей ООН в 1948 году, была первым юридическим документом, в котором излагались основные права человека, подлежащие всеобщей защите.Всеобщая декларация прав человека, которая В 2018 году ему исполнилось 70 лет, и он продолжает оставаться основой всего международного права в области прав человека. Его В 30 статьях изложены принципы и составные части действующих и будущих конвенций, договоров и других правовых документов по правам человека.
Всеобщая декларация прав человека вместе с двумя пактами — Международным пактом о гражданских и политических правах и Международным пактом об экономических, социальных и культурных правах — составляет Международный билль о правах.
Универсальное и неотчуждаемое
Принцип универсальность прав человека является краеугольным камнем международного права прав человека. Это означает, что все мы в равной степени обладаем правами человека. Этот принцип, как впервые подчеркнуто во Всеобщей декларации прав человека, повторяется во многих международных конвенциях, декларациях и резолюциях по правам человека.
Права человека неотчуждаемый . Их нельзя забирать, за исключением особых ситуаций и в соответствии с надлежащей правовой процедурой.Например, право на свободу может быть ограничено, если лицо признано виновным в совершении преступления судом.
Неделимые и взаимозависимые
Все права человека неделимый и взаимозависимый . Это означает, что одним набором прав нельзя полностью пользоваться без другого. Например, прогресс в области гражданских и политических прав облегчает осуществление экономических, социальных и культурных прав. Точно так же нарушение экономических, социальных и культурных прав может отрицательно сказаться на многих других правах.
Равные и недискриминационные
Статья 1 Всеобщей декларации прав человека гласит: «Все люди рождаются свободными и равными в своем достоинстве и правах». Свобода от дискриминации, изложенная в статье 2, — вот что обеспечивает это равенство.
Недискриминация проходит через все нормы международного права в области прав человека. Этот принцип присутствует во всех основных договорах по правам человека. Он также представляет собой центральную тему двух основных документов: Международной конвенции о ликвидации всех форм расовой дискриминации и Конвенции о ликвидации всех форм дискриминации в отношении женщин.
И права, и обязанности
Все государства ратифицировали по крайней мере 1 из 9 основные договоры по правам человека, а также 1 из 9 факультативных протоколов. 80% государств ратифицировали 4 или более. Это означает, что в соответствии с международным правом государства несут обязательства и обязанности уважать, защищать и соблюдать права человека.
- Обязательство по уважение означает, что государства должны воздерживаться от вмешательства или ограничения осуществления прав человека.
- Обязательство по защита требует, чтобы государства защищали отдельных лиц и группы от нарушений прав человека.
- Обязательство по выполнить означает, что государства должны принимать позитивные меры для содействия осуществлению основных прав человека.
Между тем, как частные лица, хотя мы имеем право на наши права человека, но мы также должны уважать и отстаивать права других людей.
Следите за нами в
Facebook,
Твиттер,
Instagram.
Выбор специальной категории объявлений
Выбор правильной категории для вашей кампании — важная часть следования нашему
.
Если вы создаете кампанию, которая включает в себя что-либо из следующего, вы должны выбрать категорию, которая лучше всего описывает ваши объявления. Эти категории применяются к объявлениям, к которым предъявляются особые требования в определенных странах, таким как отказ от ответственности и отказ от ответственности «Оплачено», предвыборная и политическая реклама или ограниченные инструменты выбора аудитории для объявлений о кредитах, возможностях трудоустройства или жилья для защиты людей на Facebook. от незаконной дискриминации.
Специальные категории объявлений
Кредит: Объявления, которые продвигают или напрямую ссылаются на возможность получения кредита, включая, помимо прочего, предложения по кредитным картам, автокредиты, услуги по ссуде для физических лиц или предприятий, ипотечные ссуды и долгосрочные финансирование. Это также включает рекламные объявления для кредитных карт, независимо от конкретного предложения.
Работа: Объявления, которые продвигают или напрямую ссылаются на возможность трудоустройства, включая, помимо прочего, частичную или полную занятость, стажировки или программы профессиональной сертификации.Связанные объявления, попадающие в эту категорию, включают рекламу досок по трудоустройству или ярмарок, услуги агрегирования или объявления с подробным описанием льгот, которые может предоставить компания, независимо от конкретного предложения о работе.
Жилье: Объявления, которые продвигают или напрямую связывают с возможностью получения жилья или сопутствующей услугой, включая, помимо прочего, объявления о продаже или аренде дома или квартиры, страховании домовладельцев, ипотечном страховании, ипотечных ссудах, ремонт жилья и жилищный фонд или услуги по оценке.Сюда не входят объявления, предназначенные для ознакомления потребителей или поставщиков жилья с их правами и обязанностями в соответствии с законами о справедливом жилищном обеспечении.
- Социальные вопросы, выборы или политика: Объявления, сделанные кандидатом на государственную должность, политическим деятелем, политической партией или защитниками от имени или в отношении кандидата на государственную должность, по результатам выборов на государственную должность. Или о любых выборах, референдумах или избирательных бюллетенях, включая избирательные кампании «выйти и проголосовать». Реклама регулируется как политическая реклама.О социальных проблемах в любом месте, где размещается реклама. Социальные вопросы — это деликатные темы, которые активно обсуждаются, могут повлиять на исход выборов или привести к / связаны с существующим или предлагаемым законодательством. Объявления о социальных проблемах стремятся повлиять на общественное мнение путем обсуждения, дебатов или защиты важных тем, таких как здоровье, а также гражданские и социальные права, или против них. Узнайте больше об объявлениях о социальных проблемах, выборах или политике.
Это неполный список примеров и не является юридической консультацией.
Создание кампании специальной категории объявлений
Чтобы создать кампанию специальной категории объявлений:
- Перейдите в Менеджер рекламы и создайте или откройте существующую кампанию.
- Выбрать Особые категории объявлений .
- В разделе Категории выберите, какая категория относится к вашей кампании.
- В разделе Страны выберите страну или страны, в которых вы хотите провести свою кампанию.
Объявления о кредите, возможностях трудоустройства или жилья
Определенные параметры таргетинга для этих объявлений ограничены или недоступны для рекламодателей из США или с таргетингом на них, а также рекламодателей с таргетингом на Канаду и некоторые страны Европы: возраст, пол или почтовый индекс, исключение таргетинг, похожие аудитории и сохраненные аудитории.Некоторые интересы также будут недоступны, когда вы создадите свою аудиторию. Аудитории, основанные на городах или местах падения булавки, будут иметь расширенный радиус. На динамические объявления распространяются те же ограничения.
Чтобы помочь вам охватить людей, которые могут быть заинтересованы в вашей рекламе, вы можете создать Специальную рекламную аудиторию. Специальная рекламная аудитория позволит вам создать аудиторию на основе сходства в поведении и активности в Интернете без использования определенных личных атрибутов, включая возраст, пол, почтовый индекс или другие аналогичные категории.Подробнее об аудиториях объявлений о кредитах, занятости и жилье.
Мы призываем вас расширять, а не ограничивать вашу аудиторию. Наши варианты таргетинга, как и все инструменты выбора аудитории на Facebook, должны использоваться инклюзивным и недискриминационным образом.
Реклама на социальные темы, выборы или политику
Для обеспечения здорового дискурса и повышения прозрачности и подотчетности рекламодателям, которые хотят размещать объявления о социальных проблемах, выборах или политике в отдельных странах, может потребоваться авторизация в стране, в которой они хотите показывать рекламу в.Для этого они должны подтвердить свою личность, предоставить дополнительную информацию о своей организации для размещения заявлений об отказе от ответственности «Оплачено» в объявлениях и внести свои объявления в публичную библиотеку объявлений на семь лет.
При создании кампаний, включающих объявления о социальных проблемах, выборах или политике, в начале процесса покупки рекламы убедитесь, что вы выбрали «Я создаю кампанию для объявлений в специальной категории объявлений». Если вы не авторизованы, вам будет предложено завершить процесс.Если вы не выберете специальную категорию объявлений, и мы определим, что ваша кампания включает рекламу (я) о социальных проблемах, выборах или политике, кампания будет отклонена.
Когда рекламодатель пытается запустить объявление с отказом от ответственности «Оплачено», которое нацелено на людей в выбранной стране, мы используем различные сигналы, чтобы определить, исходят ли объявления от авторизованного пользователя в той же стране, где они находятся. пытается запустить тематическую, предвыборную или политическую рекламу, проверяя информацию о людях, рекламных аккаунтах и страницах.Если в этой информации есть несоответствие или наши сигналы указывают на то, что лицо, редактирующее или создающее объявление, находится за пределами целевой страны, объявление будет отклонено.
Категории права на получение грин-карты | USCIS
Чтобы подать заявку на получение грин-карты, вы должны соответствовать одной из категорий, перечисленных ниже. Как только вы найдете категорию, которая может соответствовать вашей ситуации, нажмите на предоставленную ссылку, чтобы получить информацию о требованиях к участию, о том, как подать заявку и могут ли члены вашей семьи также подавать заявление вместе с вами.
| Вы можете иметь право подать заявку в качестве… | Если вы… |
|---|---|
| Ближайшие родственники гражданина США |
|
| Другой родственник гражданина США или родственник законного постоянного жителя по семейным предпочтительным категориям |
|
| Жених (невеста) У.Гражданин С. или ребенок жениха (е) |
|
| Вдова гражданина США | Вдова или вдовец гражданина США, и вы состояли в браке со своим супругом-гражданином США на момент смерти вашего супруга |
| Самостоятельная петиция VAWA — жертва побоев или крайней жестокости |
|
| Вы можете иметь право подать заявку в качестве… | Если вы… |
|---|---|
| Рабочий-иммигрант |
|
| Врач отказ от прав в отношении национальных интересов | Являются врачом, который соглашается работать полный рабочий день в клинической практике в специально отведенной зоне с недостаточным уровнем обслуживания в течение определенного периода времени, а также отвечает другим критериям отбора. |
| Инвестор-иммигрант | Инвестировали или активно инвестируете не менее 1 миллиона долларов (или 500000 долларов в целевую область занятости) в новое коммерческое предприятие в США.S., который создаст штатные должности как минимум для 10 квалифицированных сотрудников |
| Вы можете иметь право подать заявку в качестве… | Если вы… |
|---|---|
| Asylee | Получили статус убежища не менее 1 года назад |
| Беженец | Были приняты в качестве беженца не менее 1 года назад |
| Вы можете иметь право подать заявку в качестве… | Если вы… |
|---|---|
| Самостоятельная петиция VAWA — жертва побоев или крайней жестокости |
|
| Особые иммигранты для несовершеннолетних | Являетесь ли вы ребенком, который подвергался жестокому обращению, оставлению или пренебрежению со стороны ваших родителей, и у вас есть статус SIJ |
| Насилие (жертва побоев или крайней жестокости) супруг (а) или ребенок в соответствии с Законом о регулировании Кубы | Обиженный супруг или ребенок кубинского уроженца или гражданина |
| Насилие (жертва побоев или крайней жестокости) супруг или ребенок в соответствии с Законом о статусе беженца Гаити (HRIFA) | Обиженный супруг или ребенок законного постоянного жителя, получивший грин-карту на основании HRIFA |
| Вы можете иметь право подать заявку по этой категории… | Если вы… |
|---|---|
| Справедливость иммиграции беженцев из Либерии (LRIF) |
|
| Программа иммиграционной визы по программе Diversity | были отобраны для получения визы по вопросам разнообразия в лотерее Государственного департамента по вопросам разнообразия виз |
| Закон о корректировке Кубы |
|
| Супруг или ребенок, подвергшийся жестокому обращению (жертва побоев или крайней жестокости) в соответствии с Законом о кубинском урегулировании | Являются ли подвергшимся насилию супругом или ребенком кубинского уроженца или гражданина |
| Зависимый статус согласно HRIFA | Являются ли супругом или ребенком законного постоянного жителя, получившего грин-карту на основании Закона Гаити о справедливости иммиграции беженцев (HRIFA) |
| Насилие (жертва побоев или крайней жестокости) супруг или ребенок в соответствии с HRIFA | Являются ли подвергшимся насилию супругом или ребенком законного постоянного жителя, получившего грин-карту на основании HRIFA |
| Лаутенберг условно-досрочно освобожденный | были условно освобождены в U.С. как условно-досрочно освобожденный из Лаутенберга |
| Индокитайский закон об условно-досрочном освобождении от 2000 года | Вы уроженец или гражданин Вьетнама, Кампучии (Камбоджа) или Лаоса, условно освобожденный в США до 1 октября 1997 г. или ранее из Вьетнама в соответствии с программой упорядоченного выезда, лагеря беженцев в Восточной Азии или лагеря перемещенных лиц. управляется УВКБ ООН в Таиланде. |
| Американский индеец, родившийся в Канаде | Родились в Канаде, имеют не менее 50% крови американских индейцев и имеют основное место жительства в Соединенных Штатах. |
| Лицо, родившееся в США у иностранного дипломата | Родились в США у иностранного дипломатического работника, который находился в США, когда вы родились. |
| Раздел 13 (дипломат) | находились в США в качестве иностранного дипломата или высокопоставленного чиновника и не могут вернуться домой |
Справочный центр информации о жилье — Отдел человеческих отношений
Ваши справедливые жилищные права
Вы имеете право жить там, где хотите, и можете себе позволить жить. Законы, которые защищают ваши права, — это Законы о справедливом решении жилищных вопросов.
Каждый, кто живет в Соединенных Штатах, защищен от дискриминации в жилищной сфере. Это включает продажу, аренду и финансирование жилья; кредитование; оценка дома; страхование и доступность.
В соответствии с федеральными законами о справедливом жилищном обеспечении справедливое жилье означает, что вы можете свободно выбирать место проживания независимо от вашей расы, цвета кожи, национального происхождения, религии, пола, инвалидности или семейного положения. Согласно законам Делавэра о справедливом жилищном обеспечении вы также защищены независимо от вашего семейного положения, сексуальной ориентации, гендерной идентичности, вероисповедания, возраста и источника дохода.
Что такое жилищная дискриминация?
Жилищная дискриминация — это обращение с одним человеком или группой людей не так, как с другими, на основании их принадлежности к защищенному классу. Термин «защищенный класс» относится к группе людей, которые защищены законом от незаконной дискриминации. Защищенный класс назван в честь общих черт людей, таких как пол, раса, религия, сексуальная ориентация или национальное происхождение.
Жилищная дискриминация часто бывает незаметной и может принимать разные формы.Некоторые признаки возможной дискриминации включают:
- Арендодатель отказывается показать или сдать в аренду имеющееся жилье
- Агент по недвижимости направляет вас в районы с расовой сегрегацией во время обыска вашего дома
- Когда вам говорят, что квартира или многоквартирный дом «не подходит» вам и вашей семье
- Рекламные объявления о жилье, в которых говорится «без детей» или «предпочитают профессионалы»
- Отказ подать или ответить на запрос о разумном приспособлении или разрешить разумную модификацию, позволяющую человеку с ограниченными возможностями в полной мере использовать жилище
- Требование разные условия для идентичной собственности, например, взимание более высокой арендной платы или более высокого гарантийного депозита для разных арендаторов
- Притеснение или запугивание
Дискриминация в жилищной сфере может быть не такой очевидной, как раньше, но она все еще существует.По оценкам HUD, ежегодно происходит около 2 000 000 актов дискриминации в отношении жилья, но когда-либо регистрируется только 1% нарушений справедливого жилищного законодательства.
Узнайте о некоторых признаках жилищной дискриминации здесь.
Video Link
Кто защищен законами о справедливом решении жилищных вопросов?
Законы о справедливом жилищном обеспечении защищают ВАС!
Федеральные законы о справедливом жилищном обеспечении охватывают семь защищенных классов. Законы Делавэра о справедливом жилищном обеспечении запрещают дискриминацию на основании шести дополнительных защищенных классов.Это означает, что законы Делавэра о справедливом жилищном обеспечении охватывают в общей сложности 13 защищенных категорий.
Защищенные классы Делавэра:
Дополнительные защищенные классы, подпадающие под действие закона штата:
Какие действия незаконны?
Запрещается никому:
- Рекламировать или делать какие-либо заявления, указывающие на ограничение или предпочтения на основе расы, религии, цвета кожи, пола, национального происхождения, инвалидности, семейного положения, семейного положения, сексуальной ориентации, возраста, гендерной идентичности, вероисповедания или источника дохода.Этот запрет на дискриминационную рекламу распространяется на все жилье, включая жилье для одной семьи и жилье, занимаемое владельцами, которое в остальном не подпадает под действие Закона штата Делавэр о справедливом жилищном обеспечении.
- Преследовать, принуждать, запугивать, угрожать или мешать любому, кто осуществляет справедливое жилищное право или помогает другим, осуществляющим свои справедливые жилищные права. аренда жилья или ипотечное кредитование на основе расы, цвета кожи, религии, пола, национального происхождения, инвалидности, семейного положения, семейного положения, сексуальной ориентации, возраста, гендерной идентичности, вероисповедания или источника дохода.
В продаже и аренде жилья:
- Отказать в аренде или продаже жилья
- Отказаться от переговоров о жилье
- Рекламировать жилье только для избранных групп людей, например, объявление, которое гласит «только для профессионалов»
- Показать вам или вашей семье апартаменты или дома в определенных районах только
- Скажите, что жилье недоступно для осмотра, продажи или сдачи в аренду, хотя на самом деле оно доступно
- Установите другие условия или привилегии для продажи или аренды жилья
- Предоставьте различные жилищные услуги или объекты
- Запретить доступ к или членство в учреждении или услуге (например, услуги множественного листинга), связанных с продажей или арендой жилья
- Отказ от внесения определенных запрошенных изменений или приспособлений для лиц с психическими или физическими недостатками
Ипотечное кредитование:
- Отказать в выдаче ипотечной ссуды
- Отказаться в предоставлении информации о ссуде
- Наложить другие условия на ссуду, такие как разные процентные ставки, баллы или сборы
- Отказать вам в страховании имущества
- Провести оценку имущества в дискриминационным образом
- Отказ от покупки ссуды
- Установите другие условия для приобретения ипотечной ссуды
Узнайте, как эта семья боролась с жилищной дискриминацией здесь.
Другая важная информация:
Правило конфиденциальности HIPAA и его влияние на исследования
Каким образом покрываемые лица могут использовать и раскрывать Защищенная медицинская информация для исследований и соблюдать правила конфиденциальности?
Ключевые точки:- Деидентифицированная медицинская информация, как описано в Правиле конфиденциальности, не является PHI и, следовательно, не защищена Правилом конфиденциальности.
- PHI может использоваться и раскрываться для исследований с письменного разрешения физического лица в форме авторизации.
- PHI может использоваться и раскрываться для исследований без разрешения в ограниченных обстоятельствах: при отказе от требования авторизации, как ограниченный набор данных с соглашением об использовании данных, для подготовки к исследованию и для исследования информации о потомках.
Правило конфиденциальности описывает способы, которыми покрытые организации могут использовать или раскрывать PHI, в том числе в исследовательских целях. В целом Правило позволяет организациям, на которые распространяется действие страховки, использовать и раскрывать PHI для исследований, если субъект уполномочен на это в соответствии с Правилом конфиденциальности.Кроме того, при определенных обстоятельствах Правило разрешает охваченным организациям использовать и раскрывать PHI без разрешения для определенных видов исследовательской деятельности. Например, PHI может быть использована или раскрыта для исследования, если застрахованная организация получает документацию о том, что Совет по надзору организации (IRB) или Совет по конфиденциальности отказался от требования авторизации или разрешил изменение. Правило также позволяет защищенной организации заключать соглашение об использовании данных для совместного использования ограниченного набора данных. Существуют также отдельные положения о том, как PHI может быть использована или раскрыта для деятельности по подготовке к исследованию и для исследования информации о потомках.
Важно отметить, что существуют обстоятельства, при которых медицинская информация, хранимая застрахованным лицом, не защищена Правилом конфиденциальности. PHI исключает медицинскую информацию, которая не идентифицируется в соответствии с определенными стандартами. Деидентифицированная медицинская информация может быть использована и раскрыта субъектом, на который распространяется действие защиты, включая исследователя, который является субъектом защиты, без Авторизации или любого другого разрешения, указанного в Правиле конфиденциальности. В соответствии с Правилом конфиденциальности субъекты, на которые распространяется действие страхового покрытия, могут определить, что медицинская информация не может быть индивидуально идентифицирована любым из двух способов.Они описаны ниже.
Деидентификация защищенной медицинской информации в соответствии с Правилом конфиденциальности
Субъекты, на которые распространяется действие Соглашения, могут использовать или раскрывать медицинскую информацию, не идентифицируемую без ограничений в соответствии с Правилом конфиденциальности. Охватываемые организации, стремящиеся раскрыть эту медицинскую информацию, должны определить, что информация была деидентифицирована, используя либо статистическую проверку деидентификации, либо путем удаления определенных частей информации из каждой записи, как указано в Правиле.
Правило конфиденциальности позволяет субъекту, на который распространяется действие страховки, деидентифицировать данные, удаляя все 18 элементов, которые могут использоваться для идентификации человека или его родственников, работодателей или членов семьи; эти элементы перечислены в Правиле конфиденциальности. Охватываемая организация также не должна знать, что оставшаяся информация может быть использована отдельно или в сочетании с другой информацией для идентификации лица, являющегося предметом информации. В этом методе необходимо удалить следующие идентификаторы:
- Имена.
- Все географические единицы меньше штата, включая почтовый адрес, город, округ, округ, почтовый индекс и их эквивалентные географические коды, за исключением первых трех цифр почтового индекса, если, согласно текущим общедоступным данным Бюро по переписи:
- Географическая единица, образованная путем объединения всех почтовых индексов с одинаковыми тремя начальными цифрами, содержит более 20 000 человек.
- Первые три цифры почтового индекса для всех таких географических единиц, в которых проживает 20 000 человек или меньше, заменяются на 000.
- Все элементы дат (кроме года) для дат, непосредственно связанных с физическим лицом, включая дату рождения, дату поступления, дату выписки, дату смерти; и все возрасты старше 89 лет и все элементы дат (включая год), указывающие на такой возраст, за исключением того, что такие возрасты и элементы могут быть объединены в единую категорию возраста 90 лет и старше.
- Номера телефонов.
- Номера факсимильных аппаратов.
- Адреса электронной почты.
- Номера социального страхования.
- Номера медицинских карт.
- Номера получателей плана медицинского страхования.
- Номера счетов.
- Номера сертификатов / лицензий.
- Идентификаторы и серийные номера автомобилей, включая номерные знаки.
- Идентификаторы и серийные номера устройств.
- Универсальные указатели веб-ресурсов (URL).
- Номера адресов Интернет-протокола (IP).
- Биометрические идентификаторы, включая отпечатки пальцев и голоса.
- Фотоснимки анфас и любые сопоставимые изображения.
- Любой другой уникальный идентификационный номер, характеристика или код, если иное не разрешено Правилом конфиденциальности для повторной идентификации.
Охватываемые организации могут также использовать статистические методы для установления деидентификации вместо удаления всех 18 идентификаторов. Застрахованная организация может получить подтверждение от «лица, обладающего соответствующими знаниями и опытом работы с общепринятыми статистическими и научными принципами и методами предоставления информации, не поддающейся индивидуальной идентификации», что существует «очень небольшой» риск того, что информация может быть использована получателем. для идентификации лица, являющегося предметом информации, отдельно или в сочетании с другой разумно доступной информацией.Лицо, удостоверяющее статистическое обезличивание, должно задокументировать использованные методы, а также результат анализа, который оправдывает определение. Застрахованная организация должна хранить такую сертификацию в письменном или электронном формате в течение не менее 6 лет с даты ее создания или даты, когда она в последний раз действовала, в зависимости от того, что наступит позже.
Другие вопросы, связанные с деидентификацией
Согласно первому методу, уникальные идентификационные номера, характеристики или коды должны быть удалены, если медицинская информация должна считаться деидентификационной.Однако Правило конфиденциальности разрешает субъекту, на который распространяется действие страховки, назначать и сохранять вместе с медицинской информацией код или другие средства идентификации записи, если этот код не является производным или не связан с информацией о человеке и не может быть переведен для идентификации. человек. Защищенная организация не может использовать или раскрывать код или другие средства идентификации записи для каких-либо других целей и не может раскрывать свой метод повторной идентификации информации. Например, случайно назначенный код, который разрешает повторную идентификацию с помощью защищенного ключа для этого кода, не будет содержать информацию, для которой ему назначен PHI, потому что случайный код не может быть получен или связан с информацией о человеке, а также потому, что ключ к этому коду в безопасности.
Субъекту, на который распространяется действие защиты, разрешается аннулировать идентификацию PHI или привлечь делового партнера для аннулирования идентификации PHI. Например, исследователь может быть застрахованным лицом, которое он / она выполняет, или может быть нанят в качестве делового партнера для проведения деидентификации. В большинстве случаев юридическое лицо, на которое распространяется действие страховки, должно иметь письменный договор с деловым партнером, содержащий положения, требуемые Правилом конфиденциальности, до того, как оно предоставит ЗМИ деловому партнеру. Кроме того, покрываемая организация, если она является гибридной, может обозначать в своем компоненте (ах) здравоохранения части организации, которые выполняют функции, аналогичные функциям делового партнера, такие как деидентификация.
Деидентификация PHI в соответствии со стандартами Правил конфиденциальности может сделать возможным множество исследовательских работ; тем не менее, Правило конфиденциальности признает, что исследователям может потребоваться доступ к идентифицируемой медицинской информации и ее получение в ходе исследования. Если PHI необходима для исследовательской деятельности, Правило конфиденциальности разрешает ее использование и раскрытие при соблюдении определенных стандартов. Эти стандарты обсуждаются в следующих разделах.
Разрешение на использование и раскрытие информации в исследованиях
Одним из способов защиты конфиденциальности PHI Правилом конфиденциальности является предоставление людям возможности соглашаться на использование и раскрытие своей PHI путем подписания формы авторизации для использования и раскрытия информации, не разрешенных Правилом.Правило конфиденциальности устанавливает право отдельного лица, например объекта исследования, разрешать покрываемому юридическому лицу использовать и раскрывать его / ее защищенную медицинскую информацию в исследовательских целях. Это требование является дополнением к информированному согласию на участие в исследовании, которое требуется в соответствии с Правилами HHS по защите людей и другими применимыми федеральными законами и законами штата.
Зона отличия Правило конфиденциальности HIPAA Регламент HHS по защите прав человека
Раздел 45 CFR Часть 46FDA Protection
Правил защиты людей
Раздел 21 CFR, части 50 и 56Разрешения на исследования Авторизация Информированное согласие Информированное согласие Обязанности IRB / Совета по конфиденциальности Требует, чтобы застрахованная организация получила Разрешение на использование в исследовательских целях или раскрытие PHI, если не требуется разрешение регулирующих органов.Из-за этого IRB или Совет по конфиденциальности будут видеть только запросы об отмене или изменении требования авторизации. При осуществлении Правил конфиденциальности IRB или Совет по конфиденциальности не проверяют форму авторизации. IRB должен гарантировать, что информированное согласие будет запрошено и задокументировано для каждого потенциального субъекта или его законного представителя в соответствии с положениями HHS и в той мере, в какой это требуется. Если указанные критерии соблюдены, IRB может отказаться от требований либо получения информированного согласия, либо документирования информированного согласия.IRB должен просмотреть и утвердить форму авторизации, если она объединена с документом об информированном согласии. Советы по конфиденциальности не имеют полномочий в соответствии с Правилами HHS по защите прав человека. IRB должен гарантировать, что информированное согласие будет запрошено и задокументировано для каждого потенциального субъекта или его законного представителя в соответствии с правилами FDA и в той степени, в которой это требуется. Если указанные критерии соблюдены, требования для получения информированного согласия или документирования информированного согласия могут быть отменены.IRB должен просмотреть и утвердить форму авторизации, если она объединена с документом об информированном согласии. Советы по конфиденциальности не имеют полномочий в соответствии с Правилами FDA о защите людей. Элементы авторизации
Действительная авторизация с использованием правила конфиденциальности — это подписанное физическим лицом разрешение, которое позволяет защищенной организации использовать или раскрывать PHI человека для целей, а также получателя или получателей, как указано в разрешении.Когда Разрешение получено для исследовательских целей, Правило конфиденциальности требует, чтобы оно относилось только к конкретному исследованию, а не к неспецифическим исследованиям или будущим, неопределенным проектам. Правило конфиденциальности рассматривает создание и ведение исследовательского репозитория или базы данных как конкретную исследовательскую деятельность, но последующее использование или раскрытие охваченным субъектом информации из базы данных для конкретного исследования потребует отдельного разрешения, если только использование или раскрытие PHI разрешено без авторизации (обсуждается далее в этом разделе).Если разрешение на исследование получено, фактическое использование и раскрытие информации должны соответствовать тому, что указано в разрешении. Подписанное разрешение должно храниться у застрахованного лица в течение 6 лет с даты создания или даты последнего действия, в зависимости от того, что наступит позже.
Разрешение отличается от информированного согласия тем, что в нем говорится о рисках, связанных с конфиденциальностью, и указывается, как, почему и кому будет использоваться и / или раскрываться PHI для исследования.Информированное согласие, с другой стороны, предоставляет субъектам исследования описание исследования и его ожидаемых рисков и / или преимуществ, а также, среди прочего, описание того, как будет защищена конфиденциальность записей. Разрешение может быть объединено с документом об информированном согласии или другим разрешением на участие в исследовании. Независимо от того, объединено ли с информированным согласием или отдельно, Разрешение должно содержать следующие конкретные ключевые элементы и требуемые заявления, предусмотренные Правилом:
Основные элементы авторизации:
- Описание PHI, которая будет использоваться или раскрыта, определяющая информацию конкретным и значимым образом.
- Имена или другая конкретная идентификация лица или лиц (или группы лиц), уполномоченных на запрашиваемое использование или раскрытие.
- Имена или другая конкретная идентификация лица или лиц (или группы лиц), которым охваченная организация может запрашивать использование или раскрытие информации.
- Описание каждой цели запрашиваемого использования или раскрытия.
- Дата истечения срока действия разрешения или событие истечения срока действия, которое относится к отдельному лицу или к цели использования или раскрытия информации («конец исследования» или «нет» допустимы для исследования, в том числе для создания и поддержки исследовательской базы данных или репозитория. ).
- Подпись человека и дата. Если законный представитель физического лица подписывает Разрешение, необходимо также предоставить описание полномочий представителя действовать от имени физического лица.
Заявления, необходимые для авторизации:
- Заявление о праве физического лица отозвать его / ее Разрешение и о том, как это сделать, и, если применимо, исключения из права на отзыв его / ее Разрешения или ссылка на соответствующий раздел уведомления о политике конфиденциальности организации, на которую распространяется действие гарантии. .
- Может ли лечение, оплата, зачисление или право на льготы зависеть от Разрешения, включая лечение, связанное с исследованиями, и последствия отказа подписать Разрешение, если применимо.
- Заявление о потенциальном риске повторного раскрытия ЗМИ получателем. Это может быть общее заявление о том, что Правило конфиденциальности больше не может защищать медицинскую информацию, раскрываемую получателю.
Правило конфиденциальности не указывает, кто может составлять разрешение, поэтому исследователь может составить его независимо от того, является ли исследователь защищенной организацией.Однако, чтобы иметь авторизацию, соответствующую Правилам конфиденциальности, она должна быть написана простым языком и содержать основные элементы и требуемые заявления, а подписанная копия должна быть предоставлена лицу, подписывающему ее, если покрываемая организация сама запрашивает авторизацию. . Сопутствующая часть Образец языка авторизации содержит язык, который иллюстрирует включение основных элементов и требуемых операторов.
ПРИМЕЧАНИЕ. Если Авторизация разрешает раскрытие PHI физического лица лицу или организации, которые не являются покрываемым юридическим лицом, или деловым партнером, действующим от имени покрытого юридического лица (например, спонсора или источника финансирования исследования), Правило конфиденциальности не продолжает защищать PHI, раскрытую такой организации.Однако другие применимые федеральные законы и законы штата между раскрывающей защищенной организацией и получателем PHI могут устанавливать постоянную защиту раскрытой информации. В соответствии с Правилами HHS по защите людей или FDA по защите людей IRB может наложить дополнительные ограничения на использование или раскрытие исследовательской информации для защиты субъектов.
Разрешение на использование и раскрытие информации в исследовательских целях не обязательно должно иметь фиксированный срок действия или указывать конкретное событие истечения срока действия; в форме может быть указано «нет» или «конец исследовательского проекта».»Однако, несмотря на то, что Срок действия Разрешения на использование в исследованиях и раскрытие информации может не истекать, субъект исследования имеет право в любой момент отозвать свое Разрешение в письменной форме. Отзыв этого лица имеет силу, за исключением тех случаев, когда покрываемая организация предпринял действия в соответствии с Авторизацией до отзыва. Например, защищенная организация не обязана извлекать информацию, которую она раскрыла в рамках действующей авторизации, до того, как узнает об отзыве. В преамбуле к Правилу конфиденциальности говорится, что для использования в исследованиях раскрытия информации, исключение доверия позволит продолжить использование и раскрытие PHI, уже полученной с разрешением, в той степени, которая необходима для защиты целостности исследования — например, для учета отказа субъекта от исследовательского исследования, для проведения исследований научных ненадлежащее поведение или сообщение о нежелательных явлениях.
Отказ от прав или изменение требований к авторизации
Многие проекты и протоколы медицинских исследований не могут быть реализованы с использованием обезличенной информации о здоровье. Кроме того, для исследователя может оказаться невозможным получить подписанное разрешение на всю закрытую медицинскую информацию, которую исследователь должен получить для исследования. В других случаях исследователь может определить, что согласие, полученное до 14 апреля 2003 г., которое разрешает использование и раскрытие информации, полученной от субъектов исследования, является неадекватным, недостаточным или ограничивает протокол или процедуру исследования, так что разрешение может потребоваться для разрешить использование или раскрытие PHI для исследования.
Для решения этих и других ситуаций, которые могут возникнуть в ходе исследовательского проекта или протокола, Правило конфиденциальности содержит критерии для отказа или изменения разрешений со стороны IRB или другого проверяющего органа, называемого Советом по конфиденциальности. Многие положения основаны на Правилах HHS по защите прав человека. Правило конфиденциальности не меняет текущих требований, которые определяют, когда исследователи должны подавать протоколы в IRB для рассмотрения и утверждения, а также получать документы об информированном согласии.Правило конфиденциальности дополняет такие требования только тогда, когда исследователь запрашивает отказ или изменение авторизации. Если застрахованная организация использовала или раскрыла PHI для исследований с одобрения IRB или Совета по конфиденциальности об отказе или изменении авторизации, документация об этом одобрении должна храниться застрахованной организацией в течение 6 лет с даты ее создания или даты, когда она была создана. последнее действует, в зависимости от того, что наступит позже.
Для исследовательского использования и раскрытия PHI IRB или Совет по конфиденциальности могут одобрить отказ или изменение требования авторизации полностью или частично.Полный отказ от прав происходит, когда IRB или Совет по конфиденциальности определяет, что для использования и раскрытия PHI для конкретного исследовательского проекта авторизация не требуется для покрываемой организации. Частичный отказ от авторизации происходит, когда IRB или совет по конфиденциальности определяет, что застрахованное лицо не нуждается в авторизации для всех видов использования и раскрытия PHI в исследовательских целях, таких как раскрытие PHI для целей набора для исследования. IRB или Совет по конфиденциальности также могут утвердить запрос, который удаляет некоторую, но не всю PHI, или изменяет требования для авторизации (изменение).
Правило конфиденциальности не меняет требований к членству в IRB, юрисдикции по вопросам, касающимся защиты людей, или других процедурных вопросов IRB. Правило конфиденциальности гласит, что в необходимой документации должно быть указано, что IRB следовал обычным или ускоренным процедурам при рассмотрении и утверждении отказа или изменения. Таким образом, полномочия IRB действовать по запросам об отказе или изменении в соответствии с Правилом конфиденциальности дополняют другие полномочия, вытекающие из Положений HHS о защите прав человека и других применимых законодательных и нормативных актов.Процесс и критерии получения отказа от авторизации в соответствии с Правилом конфиденциальности аналогичны процессу и критериям отказа от информированного согласия в Правилах HHS по защите человеческих субъектов. Дополнительную информацию о правиле конфиденциальности и IRB можно найти в сопроводительной статье, озаглавленной Institutional Review Boards и HIPAA Privacy Rule .
Советыпо конфиденциальности — это новые альтернативные советы по обзору, уполномоченные Правилом конфиденциальности для рассмотрения запросов на изменение или отказ от Разрешения на исследования.Если застрахованная организация должна использовать или раскрывать PHI на основании отказа или изменения разрешения Совета по конфиденциальности, Совет должен быть создан в соответствии с Разделом 164.512 (i) Правил конфиденциальности. Эти положения гласят, что:
- Участники должны иметь различный опыт и соответствующую профессиональную компетенцию, если это необходимо для проверки влияния протокола исследования на права людей на неприкосновенность частной жизни и связанные с ними интересы.
- В каждом Правлении должен быть по крайней мере один член, который не связан с охваченной организацией или с какой-либо организацией, проводящей или спонсирующей исследование, и который не связан с каким-либо лицом, которое аффилировано с такими организациями.
- Участники могут не иметь конфликта интересов в отношении проектов, которые они рассматривают.
Дополнительную информацию о правилах конфиденциальности и досках конфиденциальности можно найти в сопроводительной статье, озаглавленной Доски конфиденциальности и Правило конфиденциальности HIPAA.
Документация об отказе от прав или изменении авторизации должна включать заявление с указанием IRB или Совета по конфиденциальности, которые дали одобрение, и даты одобрения. Помимо прочего, документация также должна включать утверждения о том, что IRB или Совет по конфиденциальности определили, что отказ или изменение авторизации, полностью или частично, удовлетворяет следующим критериям:
- Использование или раскрытие PHI сопряжено с минимальным риском для частной жизни людей, основанным, по крайней мере, на наличии следующих элементов:
- Надлежащий план защиты идентификаторов информации о здоровье от ненадлежащего использования и раскрытия.
- Адекватный план уничтожения идентификаторов при первой возможности, совместимой с проведением исследования (при отсутствии медицинского или исследовательского обоснования их сохранения или юридического требования об этом).
- Надлежащие письменные гарантии того, что PHI не будет повторно использоваться или раскрываться (передаваться) какому-либо другому физическому или юридическому лицу, за исключением случаев, предусмотренных законом, для уполномоченного надзора за исследовательским исследованием или для других исследований, для которых использование или раскрытие PHI будет разрешена в соответствии с Правилом конфиденциальности.
- Исследование практически не могло быть проведено без отказа или изменения.
- Исследование практически невозможно было провести без доступа к ЗМИ и ее использования.
Правило конфиденциальности не требует, чтобы IRB или Совет по конфиденциальности проверяли форму или содержание Авторизации, которую исследователь или покрываемая организация намеревается использовать, или предлагаемые виды использования и раскрытия PHI, сделанные в соответствии с Авторизацией. Согласно Правилу конфиденциальности, IRB или Совет по конфиденциальности должен только просматривать запросы на отклонение или изменение требования авторизации.
Многие исследовательские проекты осуществляются на нескольких объектах и / или требуют использования и раскрытия PHI, созданной или поддерживаемой более чем одним объектом (в совокупности многоузловых проектов ). Часто различные IRB участвуют в проверках проектов с несколькими площадками. Ожидается, что такая же ситуация произойдет с Советами по конфиденциальности. В некоторых случаях Советы по конфиденциальности и IRB будут сосуществовать. При сосуществовании этих советов Правило не требует одобрения отказа или изменения авторизации обоими органами, поскольку застрахованная организация может полагаться на отказ или изменение авторизации, одобренные любым IRB или советом по конфиденциальности, безотносительно к местонахождение утверждающего.
HHS заявила (65 Федеральный регистр 82692, 28 декабря 2000 г.), что ответственность застрахованного лица состоит в том, чтобы «получить документацию о том, что один [выделено мной] IRB или совет по конфиденциальности одобрил изменение или отказ от авторизации». Следовательно, Правило конфиденциальности позволяет использовать отказ или изменение авторизации, полученной от одного IRB или Совета по конфиденциальности, для получения PHI в связи с многосайтовым проектом. Однако HHS также признает, что «защищенные организации могут потребовать повторных проверок IRB или Совета по конфиденциальности перед раскрытием [PHI] запрашивающим исследователям» (67 Federal Register 53232, 14 августа 2002 г.).Хотя Правило конфиденциальности не касается потенциальных разделений между IRB и советами по конфиденциальности, HHS «настоятельно рекомендует исследователям уведомлять IRB и советы по конфиденциальности о любом предыдущем обзоре протокола исследования IRB или советом по конфиденциальности» (65 Федеральный регистр 82692, 28 декабря, 28 декабря, г., стр. 2000).
Зона отличия Правило конфиденциальности HIPAA Регламент HHS по защите прав человека
Раздел 45 CFR Часть 46FDA Protection
Правил защиты людей
Раздел 21 CFR, части 50 и 56Обзор совместных исследований Запросы об отмене или изменении требования авторизации рассматриваются и утверждаются IRB или Советом по конфиденциальности.Правило конфиденциальности позволяет застрахованному субъекту разумно полагаться на решение IRB или Совета по конфиденциальности, если застрахованное лицо получит соответствующую документацию о таком решении. Каждое учреждение несет ответственность за защиту прав и благополучия людей, а также за соблюдение Правил HHS по защите прав человека. С одобрения HHS учреждение, участвующее в совместном проекте, может заключить договор о совместной проверке, полагаться на проверку другого квалифицированного IRB или принять аналогичные меры во избежание дублирования усилий. Совместные исследования / исследования, проводимые несколькими учреждениями, могут использовать совместную проверку, полагаться на проверку другой квалифицированной ЭСО или аналогичные механизмы, направленные на избежание дублирования усилий. Отказ от авторизации или требования об информированном согласии Разрешает отказ или изменение авторизации, если IRB или Совет по конфиденциальности сочтут соблюденными следующие критерии: (1) Использование или раскрытие информации влечет за собой не более чем минимальный риск для конфиденциальности лиц из-за наличия как минимум следующих элементов: (a) Адекватный план защиты идентификаторов медицинской информации от ненадлежащего использования или раскрытия, (b) адекватный план уничтожения идентификаторов при первой же возможности при отсутствии медицинского или исследовательского обоснования или юридического требования сохранить их, и (c) адекватные письменные гарантии того, что PHI не будут использоваться или раскрываться третьим лицам, за исключением случаев, предусмотренных законом, для уполномоченного надзора за исследовательским исследованием или для других исследовательских целей и раскрытия информации, разрешенных Правилом конфиденциальности; (2) исследование практически не могло быть проведено без отказа или изменения; и (3) исследование практически невозможно проводить без доступа к PHI и ее использования. Разрешает IRB отказаться от некоторых или всех элементов информированного согласия или отказаться от требования о получении информированного согласия, при условии, что IRB обнаружит и задокументирует, что (1) исследование сопряжено с минимальным риском для субъектов; (2) отказ или изменение не повлияют отрицательно на права и благополучие субъектов; (3) исследование практически не могло быть проведено без отказа или изменений; и (4) при необходимости, испытуемым будет предоставлена дополнительная относящаяся к делу информация после участия. Разрешает IRB отказаться от требования к исследователю получить подписанное согласие для некоторых или всех субъектов, если он обнаружит либо (1), что единственной записью, связывающей субъекта и исследование, будет документ о согласии, и основной риск будет быть потенциальным вредом в результате нарушения конфиденциальности; или (2) что исследование представляет не более чем минимальный риск причинения вреда субъектам и не включает процедур, для которых обычно требуется письменное согласие вне контекста исследования.
Разрешает FDA отказаться от требования проверки IRB. Разрешает IRB одобрять клиническое исследование без информированного согласия субъектов при определенных обстоятельствах, указанных в 21 CFR 50.23 и 21 CFR 50.24. К ним относятся (1) обстоятельства, при которых немедленное использование исследуемого препарата, по мнению исследователя, необходимо для сохранения жизни субъекта, а времени недостаточно для получения информированного согласия; (2) обстоятельства, при которых президент США может отказаться от информированного согласия военнослужащих на введение исследуемого продукта военнослужащим; и (3) обстоятельства, связанные с экстренным исследованием.
Ограниченный набор данных и Соглашение об использовании данных
Правило конфиденциальности разрешает защищенной организации без получения авторизации или документации об отказе или изменении авторизации использовать и раскрывать PHI, включенную в ограниченный набор данных. Охватываемая организация может использовать и раскрывать ограниченный набор данных для исследовательской деятельности, проводимой им самим, другой защищенной организацией или исследователем, который не является охваченным юридическим лицом, если раскрывающая охваченная организация и получатель ограниченного набора данных заключают соглашение об использовании данных.Ограниченные наборы данных могут использоваться или раскрываться только в целях исследований, общественного здравоохранения или медицинских операций. Поскольку ограниченные наборы данных могут содержать идентифицируемую информацию, они по-прежнему являются ЗМИ. Ограниченный набор данных — Относится к PHI, которая исключает 16 категорий прямых идентификаторов и может быть использована или раскрыта в целях исследований, общественного здравоохранения или медицинских операций без получения разрешения физического лица, отказа или изменения разрешения. для его использования и раскрытия с соглашением об использовании данных. Соглашение об использовании данных — Соглашение, в которое застрахованная организация заключает с предполагаемым получателем ограниченного набора данных, которое устанавливает способы использования информации в ограниченном наборе данных и способы ее защиты.
Ограниченный набор данных описывается как информация о состоянии здоровья, которая исключает определенные перечисленные прямые идентификаторы (см. Ниже), но может включать город; штат; Индекс; элементы даты; и другие числа, характеристики или коды, не указанные в качестве прямых идентификаторов.Прямые идентификаторы, перечисленные в положениях об ограниченном наборе данных Правила конфиденциальности, применяются как к информации о человеке, так и к информации о его родственниках, работодателях или членах семьи. Следующие идентификаторы должны быть удалены из информации о состоянии здоровья, если данные квалифицируются как ограниченный набор данных:
- Имена.
- Информация о почтовом адресе, кроме города или города, штата и почтового индекса.
- Телефонные номера.
- Номера факсов.
- Адреса электронной почты.
- Номера социального страхования.
- Номера медицинских карт.
- Номера получателей плана медицинского страхования.
- Номера счетов.
- Номера сертификатов / лицензий.
- Идентификаторы и серийные номера автомобилей, включая номерные знаки.
- Идентификаторы и серийные номера устройств.
- Универсальные указатели веб-ресурсов (URL).
- Номера адресов Интернет-протокола (IP).
- Биометрические идентификаторы, включая отпечатки пальцев и голоса.
- Фотоснимки анфас и любые сопоставимые изображения.
Соглашение об использовании данных — это средство, с помощью которого защищенные организации получают удовлетворительные гарантии того, что получатель ограниченного набора данных будет использовать или раскрывать PHI в наборе данных только для определенных целей.Даже если лицо, запрашивающее ограниченный набор данных у застрахованного лица, является сотрудником или другим членом персонала застрахованного лица, между застрахованным лицом и получателем ограниченного набора данных должно быть заключено письменное соглашение об использовании данных, отвечающее требованиям Правила конфиденциальности. .
Правило конфиденциальности требует, чтобы соглашение об использовании данных содержало следующие положения:
- Конкретные разрешенные виды использования и раскрытия ограниченных данных, установленных получателем, в соответствии с целью, для которой они были раскрыты (соглашение об использовании данных не может разрешать получателю использовать или раскрывать информацию таким образом, что, если это сделано покрываемым entity, нарушит Правило конфиденциальности).
- Укажите, кому разрешено использовать или получать ограниченный набор данных.
- Условия получения получателем
- Не использовать и не раскрывать информацию, кроме разрешенных соглашением или иным образом требуемых законом.
- Используйте соответствующие меры предосторожности для предотвращения использования или раскрытия информации, за исключением случаев, предусмотренных в соглашении, и потребуйте, чтобы получатель сообщал покрываемой организации о любом использовании или раскрытии информации в нарушение соглашения, о котором стало известно получателю.
- Обязать любого агента получателя (включая субподрядчиков) соблюдать стандарты, ограничения и условия, указанные в соглашении об использовании данных в отношении информации.
- Не указывать информацию и не связываться с физическими лицами.
Если застрахованная организация является получателем ограниченного набора данных и нарушает соглашение об использовании данных, считается, что она нарушила Правило конфиденциальности. Если застрахованная организация, предоставляющая ограниченный набор данных, знает о модели действий или действий получателя, которые представляют собой существенное нарушение или нарушение соглашения об использовании данных, застрахованная организация должна предпринять разумные шаги для исправления несоответствующей деятельности или практики.Если шаги не увенчались успехом, покрываемая организация должна прекратить раскрытие PHI получателю и уведомить HHS.
Раздел 164.512 Правил конфиденциальности также устанавливает конкретные виды использования и раскрытия PHI, которые застрахованному лицу разрешено делать для исследования без Авторизации, отказа или изменения Авторизации или соглашения об использовании данных. Эти ограниченные действия включают использование или раскрытие PHI для подготовки к исследованию, а также использование или раскрытие PHI, относящейся к умершим лицам, для проведения исследований.
Мероприятия по подготовке к исследованию
Для деятельности, связанной с подготовкой к исследованию, охваченные организации могут использовать или раскрывать PHI исследователю без разрешения физического лица, отказа или изменения авторизации или соглашения об использовании данных. Однако застрахованная организация должна получить от исследователя заявления о том, что (1) использование или раскрытие запрашивается исключительно для проверки PHI, необходимой для подготовки протокола исследования или для аналогичных целей подготовки к исследованию, (2) PHI не будет удалена из охваченная организация в ходе проверки, и (3) PHI, для использования или доступа которой требуется, необходима для исследования.Субъект может разрешить исследователю делать эти заявления в письменной или устной форме.
Согласно руководству HHS по Правилу конфиденциальности,
Положение о подготовке к исследованию разрешает охваченным организациям использовать или раскрывать защищенную медицинскую информацию в целях подготовки к исследованию, например, для помощи при приеме на учебу. Однако положение 45 CFR 164.512 (i) (1) (ii) не разрешает исследователю удалять защищенную медицинскую информацию с сайта организации, на которую распространяется действие страховки. Таким образом, исследователь, который является сотрудником или членом персонала организации, на которую распространяется действие страховки, может использовать защищенную медицинскую информацию для связи с потенциальными объектами исследования [курсив добавлен]. Положение о подготовительном исследовании позволит такому исследователю идентифицировать потенциальных участников исследования с целью получения их разрешения на использование или раскрытие защищенной медицинской информации для исследовательского исследования.
В соответствии с положением о подготовке к исследованию застрахованная организация может разрешить исследователю, работающему на эту застрахованную организацию, использовать PHI для целей подготовки к исследованию.Застрахованная организация может также разрешить в качестве раскрытия PHI исследователю, который не является сотрудником этой защищенной организации, проверять PHI (в рамках этой защищенной организации) в целях подготовки к исследованию. В гибридном предприятии ситуация аналогичная. Застрахованная организация, которая является гибридной организацией, может разрешить исследователю в рамках ее компонента здравоохранения использовать без разрешения физического лица PHI для деятельности по подготовке к исследованию. Застрахованная организация может также разрешить исследователю, не входящему в состав компонента здравоохранения гибридной организации, проверять ЗМИ в рамках этого компонента здравоохранения без разрешения отдельного лица для целей подготовки к исследованию.
Исследователи должны иметь в виду, что любые подготовительные исследования, включающие исследования людей в качестве субъектов, как это определено Правилами HHS по защите человеческих субъектов, которые не исключаются иным образом, должны быть рассмотрены и одобрены IRB и должны соответствовать требованиям информированного согласия согласно правилам HHS.
Исследование защищенной информации о здоровье потомков
Чтобы использовать или раскрывать PHI умершего для исследования, защищенным организациям не требуется получать Разрешения от личного представителя или ближайших родственников, отказ или изменение Разрешения или соглашения об использовании данных.Тем не менее, застрахованное лицо должно получить от исследователя, который ищет доступ к PHI умерших (1) устные или письменные заявления о том, что использование и раскрытие требуется исключительно для исследования PHI умерших, (2) устные или письменные заявления о том, что ЗМИ, использование или раскрытие которых запрашивается, необходима для исследовательских целей, и (3) документирование по запросу лица, на которое распространяется действие страховки, смерти лиц, чья ЗМИ запрашиваются исследователями.
Другое использование и раскрытие защищенной медицинской информации
Некоторые виды использования и раскрытия PHI разрешены Правилом конфиденциальности в разделе 164.512 без Авторизации, отказа или изменения Авторизации или соглашения об использовании данных кратко излагаются ниже. Субъектам, на которые распространяется защита, которые хотят использовать и раскрывать PHI для этих или других целей, разрешенных в соответствии с разделом 164.512, следует ознакомиться с Правилом конфиденциальности для получения информации о соответствующих требованиях к реализации.
Помимо других ограниченных целей, застрахованная организация может использовать или раскрывать PHI без разрешения, а именно:
- В той степени, в которой использование или раскрытие информации требуется по закону и соответствует и ограничивается соответствующими требованиями такого закона.Например, застрахованная организация может без разрешения раскрывать PHI онкологическим регистрам, если раскрытие (или сообщение) требуется по закону. Кроме того, застрахованная организация может раскрывать Федеральному правительству без разрешения PHI, связанную с данными, впервые полученными в соответствии с федеральным соглашением в соответствии с 45 CFR 74.36 3 .
- Для раскрытия органу общественного здравоохранения, уполномоченному законом собирать или получать информацию в целях предотвращения или контроля заболеваний, травм или инвалидности.Сюда входят сообщения о заболеваниях, травмах и жизненно важных событиях, таких как рождение или смерть, а также наблюдение за общественным здоровьем, расследования и вмешательства. Например, застрахованная организация может без разрешения раскрыть PHI, связанную с неблагоприятным событием, в NIH или FDA как органы общественного здравоохранения. Дополнительное руководство по использованию и раскрытию PHI в целях общественного здравоохранения доступно в Центрах по контролю и профилактике заболеваний (2003 г.). Правило конфиденциальности HIPAA и руководство по общественному здравоохранению от CDC и U.S. Департамент здравоохранения и социальных служб. Еженедельный отчет о заболеваемости и смертности, 52.
- Лицо, подпадающее под юрисдикцию FDA в отношении регулируемого FDA продукта или деятельности, за которые это лицо несет ответственность, для целей, связанных с качеством, безопасностью или эффективностью регулируемого FDA продукта или деятельности (включая, но не ограничиваясь, отчет о неблагоприятных событиях; отслеживание продукции в соответствии с требованиями FDA; постмаркетинговое наблюдение; а также возможность отзыва продукции, ремонта, замены или ретроспективного анализа).Например, застрахованная организация может раскрывать отчеты о нежелательных явлениях / безопасности спонсорам исследуемых новых продуктов.
- Органам по надзору в сфере здравоохранения за надзорную деятельность, разрешенную законом, которая необходима, например, для надлежащего надзора за программами, регулируемыми государством. Например, поскольку Office for Human Research Protections (OHRP) является агентством по надзору за здоровьем в соответствии с Правилом конфиденциальности, покрываемая организация может раскрыть PHI без разрешения OHRP для целей определения соблюдения Правил HHS по защите людей.
Минимально необходимое ограничение
За некоторыми исключениями, Правило конфиденциальности налагает минимально необходимое требование на все разрешенные виды использования и раскрытия PHI застрахованным лицом. Это означает, что застрахованная организация должна применять политику и процедуры или разработанные ею критерии, чтобы ограничить определенные виды использования или раскрытия PHI, в том числе в исследовательских целях, «информацией, разумно необходимой для достижения цели [запрашиваемого или запрашиваемого использования или раскрытие].»Для использования, а также регулярного и повторяющегося раскрытия информации и запросов на нее защищенная организация должна разработать политики и процедуры (которые могут быть стандартными протоколами), чтобы разумно ограничить такое использование, раскрытие информации и запросы до минимума, необходимого для достижения цели использования. или раскрытие информации. В случае нестандартного раскрытия информации и запросов застрахованная организация должна рассматривать каждое раскрытие или запрос индивидуально в соответствии с разработанными ею критериями.
Существует несколько исключений из минимально необходимых требований, которые могут повлиять на исследователей (разделы 164.502 (b) и 164.514 (d) Правил конфиденциальности). Минимально необходимый стандарт не распространяется на:
- Использование и раскрытие информации с разрешения физического лица.
- Разглашение или запросы поставщика медицинских услуг о лечении.
- Раскрытие информации физическим лицам.
- Использование или раскрытие информации в соответствии с требованиями закона.
- Раскрытие информации в HHS с целью определения соблюдения Правил конфиденциальности.
- Когда требуется для соответствия другим правилам HIPAA (например,g., для заполнения обязательных или ситуативно требуемых полей данных в стандартных транзакциях).
Если не оговорено иное, охваченные организации обязаны внедрять политики и процедуры или устанавливать критерии, ограничивающие используемую, раскрываемую или запрашиваемую PHI минимальным объемом, разумно необходимым для достижения целей (например, необходимых для конкретного исследования), для которых раскрытие информации ищется. Эти политики и процедуры охваченного юридического лица будут применяться к исследователям, которые являются членами персонала покрываемого юридического лица, и могут применяться к деловым партнерам.
Правило конфиденциальности не требует, чтобы покрываемая организация во всех случаях независимо определяла, соответствует ли запрос PHI минимально необходимым требованиям. В связи с этим, Правило конфиденциальности разрешает покрываемой организации полагаться, когда это разумно, на запрос о раскрытии PHI в качестве минимально необходимого при разрешенном раскрытии информации государственным должностным лицам, раскрытии информации, запрошенной другим покрываемым юридическим лицом, или при раскрытии PHI исследователям. у которых есть документация об отказе от IRB или Совета по конфиденциальности или изменении авторизации или некоторых других заявлениях, разрешенных Правилом конфиденциальности, которые подробно обсуждаются в соответствующих публикациях, Институциональных наблюдательных советах и Правиле и конфиденциальности HIPAA, а также Советах по конфиденциальности HIPAA. Правило конфиденциальности .
Как правило конфиденциальности затрагивает права субъектов исследования?
Ключевые точки:- Правило конфиденциальности предоставляет людям определенные права в отношении того, как их медицинская информация используется и раскрывается, а также как они могут получить доступ к медицинским записям и информации о том, когда их PHI была раскрыта без их разрешения.
- Правило конфиденциальности описывает, как субъекты, на которые распространяется действие страховки, могут реализовать эти права при сохранении целостности исследовательского проекта.
Помимо установления условий для использования и раскрытия PHI, Правило конфиденциальности устанавливает определенные права людей в отношении их медицинской информации. Охватываемые организации должны предоставлять физическим лицам письменное уведомление о методах обеспечения конфиденциальности юридического лица и правах человека на неприкосновенность частной жизни. Кроме того, Правило позволяет людям получать доступ, запрашивать изменения, запрашивать ограничения и запрашивать конфиденциальную передачу определенных записей, связанных с их медицинским обслуживанием.Физическим лицам также предоставляется право запрашивать и получать письменный отчет от застрахованного лица о том, когда и почему их PHI была раскрыта без их разрешения, за исключением ограниченных обстоятельств. Физические лица также имеют право подать жалобу в организацию, на которую распространяется действие страховки, и в Секретарь здравоохранения и социальных служб, если они считают, что имело место нарушение правила конфиденциальности. В этом документе обсуждаются права человека на доступ к PHI и получение отчета о раскрытии PHI.
Доступ к защищенной медицинской информации
За некоторыми исключениями, Правило конфиденциальности гарантирует людям доступ к своим медицинским картам и другим типам медицинской информации в той мере, в какой эта информация хранится покрываемым юридическим лицом или его деловым партнером в рамках установленного набора записей.Записи исследований, которые ведутся застрахованной организацией, могут быть частью установленного набора записей, если, например, записи имеют медицинское отношение или используются для принятия решений об участниках исследования.
В большинстве случаев пациенты или субъекты исследования могут иметь доступ к своей медицинской информации в специально отведенном для этого наборе данных в удобное время и в удобном месте. Одним из исключений, среди прочего, является клиническое испытание, когда право человека на доступ может быть приостановлено на время проведения исследования, если, давая согласие на участие в исследовании, включая лечение, человек согласился на временный отказ в доступе.Тем не менее, застрахованное лицо должно проинформировать человека о том, что право доступа к его / ее медицинским картам в указанном наборе записей будет восстановлено после завершения клинического исследования. Назначенный набор записей — Группа записей, которые ведутся покрываемой организацией или для нее, которая включает (1) медицинские и платежные записи о лицах, которые ведутся покрываемым поставщиком медицинских услуг или для него;
(2) системы регистрации, оплаты, рассмотрения претензий и ведения дел или медицинских записей, поддерживаемые планом медицинского страхования или для него; или (3) используется, полностью или частично, охваченным юридическим лицом или для него для принятия решений в отношении физических лиц.Запись — это любой элемент, совокупность или группировка информации, которая включает в себя PHI и которая хранится, собирается, используется или распространяется защищенной организацией или для нее.Учет раскрытия защищенной медицинской информации
Правило конфиденциальности разрешает физическим лицам получать записи об определенных раскрытиях их PHI организациями, на которые распространяется действие данного правила, или их деловыми партнерами, включая определенные случаи раскрытия информации исследователями, которые должны соблюдать Правило.Это известно как учет раскрытия информации. Важно подчеркнуть разницу между использованием и раскрытием PHI. Как правило, использование PHI означает передачу этой информации в пределах охваченной организации. Раскрытие PHI означает передачу этой информации физическому или юридическому лицу за пределами покрываемой организации или передачу PHI от компонента здравоохранения к немедицинскому компоненту гибридной организации. Правило конфиденциальности ограничивает как использование, так и раскрытие PHI, но требует учета только определенных раскрытий PHI. После получения запроса физического лица застрахованная организация должна учитывать раскрытие ЗМИ этого физического лица, сделанное на дату выполнения требований покрываемой организацией или после нее (для большинства организаций, 14 апреля 2003 г.), если конкретное раскрытие или тип раскрытия не исключены из этого. требование к бухгалтерскому учету в Разделе 164.528 (а) Правил конфиденциальности. Например, при раскрытии PHI бухгалтерский учет не требуется:
Учет раскрытия информации — Информация, описывающая раскрытие застрахованной организацией информации о PHI, кроме лечения, оплаты и медицинских операций; раскрытие информации с Авторизации; и некоторые другие ограниченные раскрытия информации.Для тех категорий раскрытия информации, которые должны быть в бухгалтерском учете, бухгалтерский учет должен включать в себя раскрытия, которые произошли в течение 6 лет (или более короткого периода времени по запросу физического лица) до даты запроса на бухгалтерский учет. Однако раскрытие PHI до даты соответствия для застрахованной организации не является частью требований к бухгалтерскому учету. Использование — В отношении индивидуально идентифицируемой медицинской информации, совместного использования, приема на работу, применения, использования, изучения или анализа такой информации в рамках организации или компонента здравоохранения (для гибридных организаций), которые хранят такую информацию.
Раскрытие — Разглашение, передача, доступ или разглашение информации любым другим способом за пределами организации, владеющей информацией.
- Для лечения, оплаты или медицинского обслуживания.
- Имеется разрешение на раскрытие информации.
- Частному лицу о себе.
- Как часть ограниченного набора данных в соответствии с соглашением об использовании данных.
- До даты соответствия.
Право физического лица на получение отчета о раскрытии информации (за исключением случаев, когда применяется исключение) начинается с даты соблюдения требований организацией, на которую распространяется действие гарантии, и длится 6 лет с даты запроса, не включая периоды, предшествующие дате соблюдения. Следовательно, застрахованная организация должна хранить записи о раскрытии такой информации PHI в течение 6 лет.
Правило конфиденциальности допускает три метода учета раскрытия информации, связанной с исследованиями, которая осуществляется без авторизации лица или за исключением ограниченного набора данных: (1) стандартный подход, (2) подход множественного раскрытия информации и (3) альтернатива раскрытию информации с участием 50 и более лиц.Какой бы подход ни был выбран, бухгалтерский учет ведется в письменной форме и предоставляется запрашивающему лицу. Бухгалтерские отчеты для физических лиц могут включать результаты более чем одного метода бухгалтерского учета.
Стандартный учет
Стандартный учет включает для каждого раскрытия следующую информацию:
- Дата раскрытия информации.
- Имя и, если известно, адрес физического или юридического лица, получающего PHI.
- Краткое описание раскрытой PHI.
- Краткое изложение причины раскрытия информации.
Множественное раскрытие информации Бухгалтерский учет
Учет многократного раскрытия информации разрешен, если охваченная организация неоднократно раскрывала PHI одному и тому же физическому или юридическому лицу для одной цели в соответствии с Разделами 164.502 (a) (2) (ii) или 164.512 Правил конфиденциальности. Для каждого раскрытия необходимо указать следующее:
- Дата первого раскрытия информации в течение отчетного периода.
- Имя и, если известно, адрес физического или юридического лица, получающего PHI.
- Краткое описание раскрытой PHI.
- Краткое изложение причины раскрытия информации.
- Частота, периодичность или количество раскрытий информации в течение отчетного периода.
- Дата последнего раскрытия такой информации в отчетном периоде.
Альтернативный учет
Если застрахованная организация раскрыла информацию в отношении 50 или более лиц для конкретного исследовательского проекта в соответствии с Разделом 164.512 (i) Правил конфиденциальности, учет может быть ограничен следующей информацией:
- Название протокола или исследовательской деятельности.
- Описание простым языком протокола или деятельности исследования, цели исследования и критериев для выбора конкретных записей.
- Описание типа раскрытой PHI.
- Дата или период времени, в течение которого произошло или могло произойти раскрытие информации, включая дату последнего раскрытия информации в течение отчетного периода.
- Имя, адрес и номер телефона организации, спонсировавшей исследование, и исследователя, получившего PHI.
- Заявление о том, что PHI человека могла или не могла быть раскрыта для определенного протокола или исследовательской деятельности.
Если застрахованная организация использует альтернативный метод учета, она должна, если этого требует физическое лицо, помочь ему связаться со спонсором исследования и исследователем. Однако такая помощь ограничивается теми ситуациями, в которых существует разумная вероятность того, что PHI человека действительно была раскрыта для протокола исследования или деятельности.
