Замена и ремонт коробки передач Лада Калина своими руками
Ремонт, особенности и технические характеристики
Внутри машины ВАЗ 21118, как и любой другой, всегда стоит коробка передач. У такой модели, как Калина 1118, это устройство представляет собой конструкцию механического типа, которая снабжается одной ступенью заднего хода, а также 5 ступенями переднего.
Коробка переключения передач от Лада Калина.В Lada Kalina коробка передач объединяется конструктивно с дифференциалом, основной передачей. Ремонт дифференциала КПП тоже должен учитывать это.
В виде трёх алюминиевых медных картера представлен сам корпус механизма у машины ВАЗ Калина:
- Задняя крышка.
- Коробка.
- Сцепление.
Между ними наносят специальные герметики, когда осуществляется сборка, ремонт коробки передач.
Технические особенности КПП
Блок ведущих шестерней сцепляется первичным валом. Это важно учитывать, когда проводится ремонт КПП. Что касается самого первичного вала, то для него создаётся постоянное сцепление с элементами передней передачи, выполняющими аналогичные функции.
Осуществляя ремонт вторичного вала, надо помнить о том, что он обладает полой структурой. Именно благодаря ей масло без проблем доходит до ведомых шестерней.
Внутри механизма можно найти также ведомые подшипники, синхронизаторы. Когда проводится замена кулисы своими силами, эта деталь тоже может быть заменена. Этого требует и ремонт карданчика кулисы КПП.
Устройство КПП такого, что при ремонте не обойтись без использования специальных схем. Не более 0,07 миллиметров составляет в этом случае радиальный зазор на роликовых подшипниках.
Ремонт кулисы КПП — тоже довольно сложный процесс. Особенно, учитывая, что 0,04 миллиметров не должен превышать этот же показатель, но для шариковых аналогов.
Месторасположение кулисы КПП на Лада Калина.Маслосборник отвечает за подачу масла. Он находится в области переднего подшипника, зафиксированного за вторичным валом. Капитальный ремонт часто затрагивает и такие детали. Если подобрать нужную толщину колец — появится возможность регулировать показатель натяга. Размеры сальников легко найти в инструкции, эти детали заменяются без проблем даже в домашних условиях.
Он находится в области переднего подшипника, зафиксированного за вторичным валом. Капитальный ремонт часто затрагивает и такие детали. Если подобрать нужную толщину колец — появится возможность регулировать показатель натяга. Размеры сальников легко найти в инструкции, эти детали заменяются без проблем даже в домашних условиях.
При ремонте ручки КПП необходимо помнить о том, что к фланцу дифференциала прикрепляется ведомая шестерня у коробки передач на этой машине. Посредством салуна с атмосферой совмещается сама коробка, находящаяся в верхней части конструкции, которую мы рассматриваем.
Ремонт рычага — не единственная операция, которую необходимо проводить время от времени. Иногда требуется заменить подшипники, это делается при появлении постороннего шума. Комплект для ремонта КПП нужно приобрести, если лишний шум стал заметен во время нажатия, отпускания педали сцепления.
Все элементы привода управления коробки передач Лада Калина.Руководство по ремонту говорит о том, что управляется коробка с помощью привода, который состоит из нескольких элементов:
- Штока переключателя.
- Шаровая опора.
- Рычаг.
Согласно руководству, тросовые конструкции всегда оснащаются реактивной тягой, тогда передачи не выключаются сами по себе. Один из концов тяги связан с рычагом, а второй — с мотором. Если сальники внутренних шарниров вышли из строя, необходимо провести самостоятельный ремонт КПП. Но перед тем как их заменить, надо полностью сменить масло. Привод передних колёс отсоединяется полностью.
Обслуживание коробки передач предполагает использование отвёртки для снятия необходимых деталей. Но нужно будет приобрести оправку с нужными параметрами, чтобы провести прессовку.
Три оси присутствуют на системе переключения. Одна ось снабжается трёхплечим рычагом для выбора и выключения передач. Коробка переключения передач у второй оси отсутствует, но зато есть скобы, блокирующие поворачивание.
Демонтаж и монтаж коробки передач
Обслуживание коробки передач предполагает, что механизм придётся снимать, менять его позицию. Перед этим необходимо установить на подъёмник само транспортное средство. Зажигание необходимо полностью выключить и обязательно пригодиться стояночный тормоз.
Как ремонтировать коробку передач? Для этого от аккумулятора отсоединяют клемму «минус». Капот необходимо открыть полностью. Об этом пишет любой справочник по ремонту КПП.
Крышка масляной горловины тоже демонтируется. Необходимо установить предыдущий элемент после того, как снят экран. Коробка переключения передач требует ослабления хомута, ответственного за фиксацию. От соответствующего датчика необходимо отсоединить шланг впускной трубы. Люфт рычага коробки передач требует таких же действий на практике. Затем надо отвернуть гайку воздухозаборника.
Ход ремонта далее зависит от конкретной неисправности.
Коробка передач Лада Калина после демонтажа и разборки.КПП можно установить на прежнее место после того, как ремонт 1 скорости будет завершён. На наружную поверхность соответствующей втулки в сцеплении наносится смазка ШРУС-4, очень тонким слоем. Это поможет и в том случае, когда болтается КПП. К поворотным кулакам отворачиваются болты фиксации пальцев.
Заклинило рычаг КПП
В любом случае необходимо извлечь последний крепёжный элемент после того, как будет отвёрнута к кронштейну кузова гайка болта, фиксирующая левый рычаг подвески.
Ремонт подушки коробки не обходится без многих действий, о которых писалось выше.
После этого останется только снять рычаг. Ещё один довольно важный элемент — вилка КПП, за её состоянием тоже надо следить.
В ёмкость нужно будет слить всё оставшееся масло. Кап ремонт КПП предполагает и выворачивания из шестерён полуосей дифференциала такой детали, как привод колёс.
Любые подобные работы, в том числе и ремонт вторичного вала, должны учитывать общую схему коробки передач, основной принцип её работы. Её содержит книга по ремонту коробки. То же самое касается функциональности составных элементов, иначе опора рычага КПП не может быть заменена, как и другие детали.
Демонтаж КПП Лада Калина на специализированной СТО.Особенности ремонта полностью знакомы только настоящим профессионалам. Лучше доверить работу им, если нет должного опыта, некоторых практических навыков.
Необходимо полностью промыть механизм водой перед тем, как разбирать его, выявлять неисправность КПП. Проблемы при ремонте могут возникнуть, если не установить саму деталь на специальном стенде. Полностью демонтируется кронштейн, который отвечает за фиксацию троса сцепления, подвеску мотора.
Многие дают полезные советы по замене КПП ВАЗ. Согласно им, в любом случае понадобится снять заднюю крышку у картера.
Как снять КПП
Болт фиксации вилки и гайки нужно отвернуть после того, как снят стопор первичного вала. То же самое придётся делать, если необходимо произвести замену короткоходной кулисы КПП.
Со вторичного вала надо демонтировать шлиц. Схема сборки коробки предполагает обратный порядок действий.
Ремонтируем автомобиль Лада Калина самостоятельно:
Ремонт кпп калина своими руками видео – АвтоТоп
Ремонт, особенности и технические характеристики
Внутри машины ВАЗ 21118, как и любой другой, всегда стоит коробка передач. У такой модели, как Калина 1118, это устройство представляет собой конструкцию механического типа, которая снабжается одной ступенью заднего хода, а также 5 ступенями переднего.
Коробка переключения передач от Лада Калина.
В Lada Kalina коробка передач объединяется конструктивно с дифференциалом, основной передачей. Ремонт дифференциала КПП тоже должен учитывать это.
В виде трёх алюминиевых медных картера представлен сам корпус механизма у машины ВАЗ Калина:
Между ними наносят специальные герметики, когда осуществляется сборка, ремонт коробки передач.
Технические особенности КПП
Блок ведущих шестерней сцепляется первичным валом. Это важно учитывать, когда проводится ремонт КПП. Что касается самого первичного вала, то для него создаётся постоянное сцепление с элементами передней передачи, выполняющими аналогичные функции.
Осуществляя ремонт вторичного вала, надо помнить о том, что он обладает полой структурой. Именно благодаря ей масло без проблем доходит до ведомых шестерней.
Внутри механизма можно найти также ведомые подшипники, синхронизаторы. Когда проводится замена кулисы своими силами, эта деталь тоже может быть заменена. Этого требует и ремонт карданчика кулисы КПП.
Устройство КПП такого, что при ремонте не обойтись без использования специальных схем. Не более 0,07 миллиметров составляет в этом случае радиальный зазор на роликовых подшипниках.
Ремонт кулисы КПП — тоже довольно сложный процесс. Особенно, учитывая, что 0,04 миллиметров не должен превышать этот же показатель, но для шариковых аналогов.
Месторасположение кулисы КПП на Лада Калина.
Маслосборник отвечает за подачу масла. Он находится в области переднего подшипника, зафиксированного за вторичным валом. Капитальный ремонт часто затрагивает и такие детали. Если подобрать нужную толщину колец — появится возможность регулировать показатель натяга. Размеры сальников легко найти в инструкции, эти детали заменяются без проблем даже в домашних условиях.
При ремонте ручки КПП необходимо помнить о том, что к фланцу дифференциала прикрепляется ведомая шестерня у коробки передач на этой машине. Посредством салуна с атмосферой совмещается сама коробка, находящаяся в верхней части конструкции, которую мы рассматриваем.
Посредством салуна с атмосферой совмещается сама коробка, находящаяся в верхней части конструкции, которую мы рассматриваем.
Ремонт рычага — не единственная операция, которую необходимо проводить время от времени. Иногда требуется заменить подшипники, это делается при появлении постороннего шума. Комплект для ремонта КПП нужно приобрести, если лишний шум стал заметен во время нажатия, отпускания педали сцепления.
Все элементы привода управления коробки передач Лада Калина.
- Штока переключателя.
- Шаровая опора.
- Рычаг.
Согласно руководству, тросовые конструкции всегда оснащаются реактивной тягой, тогда передачи не выключаются сами по себе. Один из концов тяги связан с рычагом, а второй — с мотором. Если сальники внутренних шарниров вышли из строя, необходимо провести самостоятельный ремонт КПП. Но перед тем как их заменить, надо полностью сменить масло. Привод передних колёс отсоединяется полностью.
Обслуживание коробки передач предполагает использование отвёртки для снятия необходимых деталей. Но нужно будет приобрести оправку с нужными параметрами, чтобы провести прессовку.
Три оси присутствуют на системе переключения. Одна ось снабжается трёхплечим рычагом для выбора и выключения передач. Коробка переключения передач у второй оси отсутствует, но зато есть скобы, блокирующие поворачивание. После каждых 75 тысяч километров пробега эту конструкцию полностью меняют. Люфт рычага коробки передач тоже должен насторожить, как и выход из строя других деталей.
Демонтаж и монтаж коробки передач
Обслуживание коробки передач предполагает, что механизм придётся снимать, менять его позицию. Перед этим необходимо установить на подъёмник само транспортное средство. Зажигание необходимо полностью выключить и обязательно пригодиться стояночный тормоз.
Как ремонтировать коробку передач? Для этого от аккумулятора отсоединяют клемму «минус». Капот необходимо открыть полностью. Об этом пишет любой справочник по ремонту КПП.
Капот необходимо открыть полностью. Об этом пишет любой справочник по ремонту КПП.
Крышка масляной горловины тоже демонтируется. Необходимо установить предыдущий элемент после того, как снят экран. Коробка переключения передач требует ослабления хомута, ответственного за фиксацию. От соответствующего датчика необходимо отсоединить шланг впускной трубы. Люфт рычага коробки передач требует таких же действий на практике. Затем надо отвернуть гайку воздухозаборника.
Ход ремонта далее зависит от конкретной неисправности.
Коробка передач Лада Калина после демонтажа и разборки.
КПП можно установить на прежнее место после того, как ремонт 1 скорости будет завершён. На наружную поверхность соответствующей втулки в сцеплении наносится смазка ШРУС-4, очень тонким слоем. Это поможет и в том случае, когда болтается КПП. К поворотным кулакам отворачиваются болты фиксации пальцев.
Заклинило рычаг КПП
В любом случае необходимо извлечь последний крепёжный элемент после того, как будет отвёрнута к кронштейну кузова гайка болта, фиксирующая левый рычаг подвески.
Ремонт подушки коробки не обходится без многих действий, о которых писалось выше.
После этого останется только снять рычаг. Ещё один довольно важный элемент — вилка КПП, за её состоянием тоже надо следить.
В ёмкость нужно будет слить всё оставшееся масло. Кап ремонт КПП предполагает и выворачивания из шестерён полуосей дифференциала такой детали, как привод колёс. Заглушки ставятся на то место, где раньше были шестерни. После того как регулировка КПП закончена, обычно переходят к установке левой опоры подвески, кронштейнов задней части автомобиля.
Любые подобные работы, в том числе и ремонт вторичного вала, должны учитывать общую схему коробки передач, основной принцип её работы. Её содержит книга по ремонту коробки. То же самое касается функциональности составных элементов, иначе опора рычага КПП не может быть заменена, как и другие детали.
Демонтаж КПП Лада Калина на специализированной СТО.
Особенности ремонта полностью знакомы только настоящим профессионалам. Лучше доверить работу им, если нет должного опыта, некоторых практических навыков.
Необходимо полностью промыть механизм водой перед тем, как разбирать его, выявлять неисправность КПП. Проблемы при ремонте могут возникнуть, если не установить саму деталь на специальном стенде. Полностью демонтируется кронштейн, который отвечает за фиксацию троса сцепления, подвеску мотора.
Многие дают полезные советы по замене КПП ВАЗ. Согласно им, в любом случае понадобится снять заднюю крышку у картера.
Как снять КПП
Болт фиксации вилки и гайки нужно отвернуть после того, как снят стопор первичного вала. То же самое придётся делать, если необходимо произвести замену короткоходной кулисы КПП.
Со вторичного вала надо демонтировать шлиц. Схема сборки коробки предполагает обратный порядок действий.
Внутри машины ВАЗ 21118, как и любой другой, всегда стоит коробка передач. У такой модели, как Калина 1118, это устройство представляет собой конструкцию механического типа, которая снабжается одной ступенью заднего хода, а также 5 ступенями переднего.
В Lada Kalina коробка передач объединяется конструктивно с дифференциалом, основной передачей. Ремонт дифференциала КПП тоже должен учитывать это.
В виде трёх алюминиевых медных картера представлен сам корпус механизма у машины ВАЗ Калина:
Между ними наносят специальные герметики, когда осуществляется сборка, ремонт коробки передач.
Технические особенности КПП
Блок ведущих шестерней сцепляется первичным валом. Это важно учитывать, когда проводится ремонт КПП. Что касается самого первичного вала, то для него создаётся постоянное сцепление с элементами передней передачи, выполняющими аналогичные функции.
Осуществляя ремонт вторичного вала, надо помнить о том, что он обладает полой структурой. Именно благодаря ей масло без проблем доходит до ведомых шестерней.
Именно благодаря ей масло без проблем доходит до ведомых шестерней.
Внутри механизма можно найти также ведомые подшипники, синхронизаторы. Когда проводится замена кулисы своими силами, эта деталь тоже может быть заменена. Этого требует и ремонт карданчика кулисы КПП.
Устройство КПП такого, что при ремонте не обойтись без использования специальных схем. Не более 0,07 миллиметров составляет в этом случае радиальный зазор на роликовых подшипниках.
Ремонт кулисы КПП — тоже довольно сложный процесс. Особенно, учитывая, что 0,04 миллиметров не должен превышать этот же показатель, но для шариковых аналогов.
Маслосборник отвечает за подачу масла. Он находится в области переднего подшипника, зафиксированного за вторичным валом. Капитальный ремонт часто затрагивает и такие детали. Если подобрать нужную толщину колец — появится возможность регулировать показатель натяга. Размеры сальников легко найти в инструкции, эти детали заменяются без проблем даже в домашних условиях.
При ремонте ручки КПП необходимо помнить о том, что к фланцу дифференциала прикрепляется ведомая шестерня у коробки передач на этой машине. Посредством салуна с атмосферой совмещается сама коробка, находящаяся в верхней части конструкции, которую мы рассматриваем.
При ремонте ручки КПП необходимо помнить о том, что к фланцудифференциала прикрепляется ведомая шестерня у коробки передач на этой машине. Посредством салуна с атмосферой совмещается сама коробка, находящаяся в верхней части конструкции, которую мы рассматриваем. Ремонт рычага — не единственная операция, которую необходимо проводить время от времени. Иногда требуется заменить подшипники, это делается при появлении постороннего шума. Комплект для ремонта КПП нужно приобрести, если лишний шум стал заметен во время нажатия, отпускания педали сцепления.
Руководство по ремонту говорит о том, что управляется коробка с помощью привода, который состоит из нескольких элементов:
- Штока переключателя.

- Шаровая опора.
- Рычаг.
Согласно руководству, тросовые конструкции всегда оснащаются реактивной тягой, тогда передачи не выключаются сами по себе. Один из концов тяги связан с рычагом, а второй — с мотором. Если сальники внутренних шарниров вышли из строя, необходимо провести самостоятельный ремонт КПП. Но перед тем как их заменить, надо полностью сменить масло. Привод передних колёс отсоединяется полностью.
Обслуживание коробки передач предполагает использование отвёртки для снятия необходимых деталей. Но нужно будет приобрести оправку с нужными параметрами, чтобы провести прессовку.
Три оси присутствуют на системе переключения. Одна ось снабжается трёхплечим рычагом для выбора и выключения передач. Коробка переключения передач у второй оси отсутствует, но зато есть скобы, блокирующие поворачивание. После каждых 75 тысяч километров пробега эту конструкцию полностью меняют. Люфт рычага коробки передач тоже должен насторожить, как и выход из строя других деталей.
Демонтаж и монтаж коробки передач
Обслуживание коробки передач предполагает, что механизм придётся снимать, менять его позицию. Перед этим необходимо установить на подъёмник само транспортное средство. Зажигание необходимо полностью выключить и обязательно пригодиться стояночный тормоз.
Как ремонтировать коробку передач? Для этого от аккумулятора отсоединяют клемму «минус». Капот необходимо открыть полностью. Об этом пишет любой справочник по ремонту КПП.
Крышка масляной горловины тоже демонтируется. Необходимо установить предыдущий элемент после того, как снят экран. Коробка переключения передач требует ослабления хомута, ответственного за фиксацию. От соответствующего датчика необходимо отсоединить шланг впускной трубы. Люфт рычага коробки передач требует таких же действий на практике. Затем надо отвернуть гайку воздухозаборника.
Ход ремонта далее зависит от конкретной неисправности.
Заклинило рычаг КПП
В любом случае необходимо извлечь последний крепёжный элемент после того, как будет отвёрнута к кронштейну кузова гайка болта, фиксирующая левый рычаг подвески.
Ремонт подушки коробки не обходится без многих действий, о которых писалось выше.
После этого останется только снять рычаг. Ещё один довольно важный элемент — вилка КПП, за её состоянием тоже надо следить.
В ёмкость нужно будет слить всё оставшееся масло. Кап ремонт КПП предполагает и выворачивания из шестерён полуосей дифференциала такой детали, как привод колёс. Заглушки ставятся на то место, где раньше были шестерни. После того как регулировка КПП закончена, обычно переходят к установке левой опоры подвески, кронштейнов задней части автомобиля.
Любые подобные работы, в том числе и ремонт вторичного вала, должны учитывать общую схему коробки передач, основной принцип её работы. Её содержит книга по ремонту коробки. То же самое касается функциональности составных элементов, иначе опора рычага КПП не может быть заменена, как и другие детали.
Особенности ремонта полностью знакомы только настоящим профессионалам. Лучше доверить работу им, если нет должного опыта, некоторых практических навыков.
Необходимо полностью промыть механизм водой перед тем, как разбирать его, выявлять неисправность КПП. Проблемы при ремонте могут возникнуть, если не установить саму деталь на специальном стенде. Полностью демонтируется кронштейн, который отвечает за фиксацию троса сцепления, подвеску мотора.
Многие дают полезные советы по замене КПП ВАЗ. Согласно им, в любом случае понадобится снять заднюю крышку у картера.
Как снять КПП
Болт фиксации вилки и гайки нужно отвернуть после того, как снят стопор первичного вала. То же самое придётся делать, если необходимо произвести замену короткоходной кулисы КПП.
Со вторичного вала надо демонтировать шлиц. Схема сборки коробки предполагает обратный порядок действий.
Разборка и сборка коробки передач
Снимаем коробку передач (см. «Снятие и установка коробки передач»).
Снаружи очищаем ее от грязи (не допускайте попадания грязи внутрь коробки). Снимаем датчик скорости (см. «Снятие датчика скорости»).
Снимаем датчик скорости (см. «Снятие датчика скорости»).
Для удобства дальнейшей разборки коробки передач навинчиваем на крепежную шпильку картера сцепления две гайки.
. и выворачиваем шпильку из картера сцепления.
Устанавливаем коробку передач на верстак картером сцепления вниз.
Накидным ключом «на 13» отворачиваем пробку фиксатора вилки включения передачи заднего хода.
Вынимаем из отверстия картера пружину фиксатора.
. и, используя магнит, шарик фиксатора.
Выворачиваем из отверстий картера коробки передач соленоид блокировки включения передачи заднего хода (см. «Замена соленоида блокировки включения передачи заднего хода») и выключатель света заднего хода (см. «Снятие выключателя света заднего хода»)
Накидным ключом «на 13» отворачиваем гайку крепления задней крышки картера коробки передач, которая одновременно крепит кронштейн троса привода выключения сцепления.
Накидным ключом «на 17» отворачиваем болт крепления кронштейна троса привода выключения сцепления.
. и снимаем кронштейн.
Накидным ключом «на 13» отворачиваем еще пять гаек крепления задней крышки картера.
Постукивая молотком с пластмассовым наконечником или обычным молотком через оправку из мягкого металла по приливам крышки.
. снимаем ее со шпилек.
Для отворачивания гаек валов необходимо застопорить валы от проворачивания, включив сразу две передачи. Для этого, вдавив до упора шток переключателя передач, включаем III передачу.
Накидным ключом «на 10» отворачиваем болт крепления вилки V передачи.
Через выколотку из мягкого металла наносим удар по вилке, включая V передачу.
Бородком выправляем места кернения буртиков гаек первичного и вторичного валов.
Головкой «на 32» с мощным воротком.
. отворачиваем гайки валов.
Поддев отверткой ведомую шестерню V передачи, снимаем узел V передачи в сборе.
Вынимаем вилку включения V передачи.
Пометив положение блокирующего кольца синхронизатора относительно муфты.
. снимаем шестерню V передачи с блокирующим кольцом синхронизатора.
Снимаем блокирующее кольцо синхронизатора.
Вынимаем упорную пластину синхронизатора.
Отверткой поддеваем втулку ведомой шестерни V передачи.
. и снимаем ее со вторичного вала.
В зазор между упорной пластиной и ведущей шестерней V передачи вставляем одну или две отвертки. Поддевая отверткой (отвертками) шестерню.
. спрессовываем ее с первичного вала.
Снимаем с вторичного вала упорное кольцо.
Ударной отверткой с крестообразным наконечником РНЗ отворачиваем четыре винта крепления упорной пластины подшипников.
Под головками винтов установлены специальные стопорные шайбы.
Накидным ключом «на 13» отворачиваем три пробки фиксаторов штоков вилок переключения передач.
Вынимаем из гнезд пружины.
. и извлекаем магнитной отверткой шарики фиксаторов.
Двумя отвертками разжимаем концы стопорного кольца заднего подшипника первичного вала.
. и вынимаем кольцо из проточки картера.
Аналогично снимаем стопорное кольцо заднего подшипника на вторичном вале.
Накидным ключом «на 13» отворачиваем один болт и тринадцать гаек крепления картера коробки передач к картеру сцепления.
Вставив в паз на стыке приваленных плоскостей картеров отвертку, аккуратно приподнимаем картер коробки передач.
Вынимаем из углубления картера сцепления магнит.
Накидным ключом «на 10» отворачиваем болт крепления вилки включения I-II передач к штоку.
Приподнимаем шток вверх и выводим вилку из проточки скользящей муфты синхронизатора.
Накидным ключом «на 10» отворачиваем болт крепления вилки включения III-IV передач к штоку.
. и отверткой выводим рычаг штока из зацепления в механизме переключения передач.
и отверткой выводим рычаг штока из зацепления в механизме переключения передач.
Поднимаем шток вверх и выводим вилку из проточки скользящей муфты синхронизатора.
Поворачивая шток вилки включения V передачи, выводим рычаг штока из зацепления в механизме переключения передач.
Вынимаем ось промежуточной шестерни передачи заднего хода.
Вынимаем промежуточную шестерню передачи заднего хода.
Головкой «на 10» отворачиваем три болта крепления механизма переключения передач.
Вынимаем одновременно первичный и вторичный валы из роликовых подшипников картера сцепления.
Вынимаем дифференциал в сборе.
Карданный шарнир штока переключателя передач можно заменить на автомобиле (не демонтируя коробку передач), отсоединив от хвостовика шарнира тягу управления коробкой передач (см. «Снятие и разборка привода управления коробкой передач»). Для наглядности операции по снятию шарнира показываем на демонтированной коробке передач Сдвигаем защитный резиновый чехол с шарнира штока.
. и головкой «на 10» отворачиваем конический винт шарнира.
Снимаем со штока шарнир .
. и защитный чехол шарнира.
Если требуется снять переключатель передач или его шток.
. головкой «на 10» отворачиваем конический винт крепления переключателя передач.
Выдвигая шток из отверстия картера..
. снимаем со штока переключатель передач.
Замену сальника штока переключателя передач см. в разделе «Замена чехла шарнира штока преключателя передач и сальника штока».
Отверткой извлекаем из сепаратора ролики переднего подшипника вторичного вала.
Вынимаем сепаратор подшипника.
Зацепив крючком ударного съемника буртик наружного кольца подшипника.
. выпрессовываем наружное кольцо подшипника.
Извлекаем маслосборник.
Таким же образом выпрессовываем наружное кольцо подшипника первичного вала.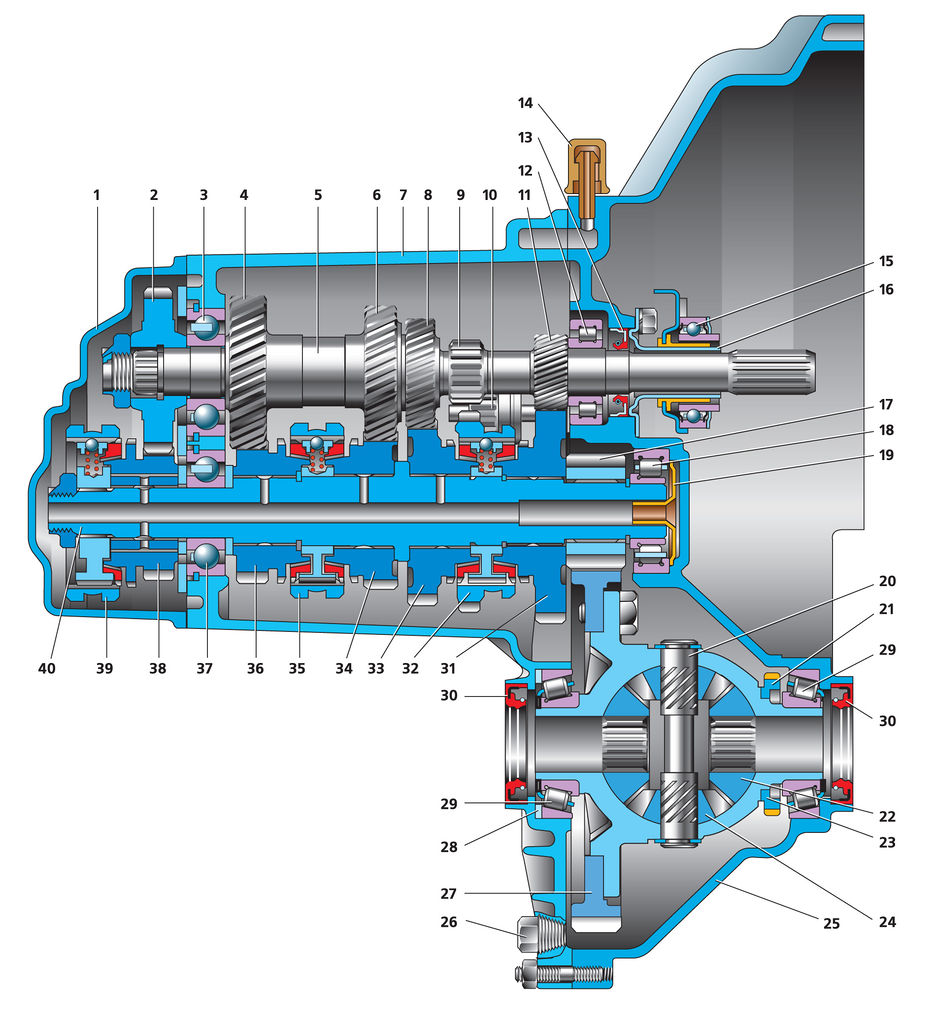
Подходящим отрезком трубы выбиваем из картера сцепления.
. сальник привода колеса.
Через бородок наносим удары в торец наружного кольца подшипника дифференциала.
. и выпрессовываем кольцо.
Таким же образом выбиваем сальник и наружное кольцо подшипника дифференциала из картера коробки передач. Вынимаем регулировочное кольцо.
Ремонт трансмиссии, коробки передач Лада Калина своими руками
ЛАДА
/КАЛИНА
/ремонт
/трансмиссия
Ремонт трансмиссии, коробки передач Лада Калина своими руками
. Обслуживание коробки ваз 1118 калина. Устройство сцепления, привода колес ваз 1117 калина. Дифференциала ваз 1119 лада калина. Руководство по обслуживанию и эксплуатации Лада Калина, с инжекторными двигателями 1.4 и 1.6. Автовладелец с легкостью сможет провести диагностику и ремонт агрегата автомобиля Lada Kalina своими силами в гаражной мастерской, найти неисправность в электрооборудовании, рулевом управлении, тормозной системе, двигателе и кпп. Советы по уходу можно также найти в наших разделах. Все руководства Лада Калина разбиты на тематические разделы.Сцепление и его привод: 1 — трос привода сцепления; 2 — оболочка троса; 3 — нижний наконечник оболочки троса; 4 — защитный чехол; 5 — поводок; б — рычаг вилки; 7 — направляющая втулка подшипника; 8 — подшипник выключения сцепления; 9 — кожух сцепления; 10 — нажимная пружина; 11 — нажимной (ведущий) диск сцепления; 12 — маховик; 13 — фрикционные накладки ведомого диска; 14 — ведомый диск; 15 — пружина демпфера; 16 —
Коробка передач: 1 — задняя крышка картера коробки передач; 2 — ведущая шестерня V передачи; 3 — шариковый подшипник первичного вала; 4 — ведущая шестерня IV передачи; 5 — первичный вал; б — ведущая шестерня Ш передачи; 7 — картер коробки передач; 8 — ведущая шестерня II передачи; 9 — шестерня заднего хода; 10 — промежуточная шестерня заднего хода; 11 — ведущая шестерня ! передачи ; 12 — роликовый подшипник
Привод передних колес лада калина: 1 — стопорное кольцо корпуса внутреннего шарнира; 2 — корпус внутреннего шарнира; 3 — защитное кольцо корпуса внутреннего шарнира; 4 — упор вала; 5 — стопорное кольцо; 6 — обойма; 7 — шарик; 8 — упорное кольцо; 9 — сепаратор; 10 — большой хомут; 11 — фиксатор внутреннего шарнира; 12 — защитный чехол; 13 — малый хомут; 14 — кольцо клапана; 15 — кожух клапана; 16 — вал; 17— защитное
ЛАДА КАЛИНА:Разборка и сборка коробки передач
Снимаем коробку передач .
Снаружи очищаем ее от грязи (не допускайте попадания грязи внутрь коробки). Снимаем датчик скорости .
Для удобства дальнейшей разборки коробки передач навинчиваем на крепежную шпильку картера сцепления две гайки…
…и выворачиваем шпильку из картера сцепления.
Устанавливаем коробку передач на верстак картером сцепления вниз.
Накидным ключом «на 13» отворачиваем пробку фиксатора вилки включения передачи заднего хода.
Вынимаем из отверстия картера пружину фиксатора…
Накидным ключом «на 13» отворачиваем гайку крепления задней крышки картера коробки передач, которая одновременно крепит кронштейн троса привода выключения сцепления.
Накидным ключом «на 17» отворачиваем болт крепления кронштейна троса привода выключения сцепления…
…и снимаем кронштейн.
Накидным ключом «на 13» отворачиваем еще пять гаек крепления задней крышки картера.
Постукивая молотком с пластмассовым наконечником или обычным молотком через оправку из мягкого металла по приливам крышки…
…снимаем ее со шпилек.
Для отворачивания гаек валов необходимо застопорить валы от проворачивания, включив сразу две передачи. Для этого, вдавив до упора шток переключателя передач, включаем III передачу.
Накидным ключом «на 10» отворачиваем болт крепления вилки V передачи.
Через выколотку из мягкого металла наносим удар по вилке, включая V передачу.
Бородком выправляем места кернения буртиков гаек первичного и вторичного валов.
Головкой «на 32» с мощным воротком…
…отворачиваем гайки валов.
Поддев отверткой ведомую шестерню V передачи, снимаем узел V передачи в сборе.
Вынимаем вилку включения V передачи.
Пометив положение блокирующего кольца синхронизатора относительно муфты…
…снимаем шестерню V передачи с блокирующим кольцом синхронизатора.
Снимаем блокирующее кольцо синхронизатора.
Вынимаем упорную пластину синхронизатора.
Отверткой поддеваем втулку ведомой шестерни V передачи…
…и снимаем ее со вторичного вала.
В зазор между упорной пластиной и ведущей шестерней V передачи вставляем одну или две отвертки. Поддевая отверткой (отвертками) шестерню…
…спрессовываем ее с первичного вала.
Снимаем с вторичного вала упорное кольцо.
Ударной отверткой с крестообразным наконечником РНЗ отворачиваем четыре винта крепления упорной пластины подшипников.
Под головками винтов установлены специальные стопорные шайбы.
Снимаем пластину.
Накидным ключом «на 13» отворачиваем три пробки фиксаторов штоков вилок переключения передач.
Вынимаем из гнезд пружины…
…и извлекаем магнитной отверткой шарики фиксаторов.
Двумя отвертками разжимаем концы стопорного кольца заднего подшипника первичного вала…
…и вынимаем кольцо из проточки картера.
Аналогично снимаем стопорное кольцо заднего подшипника на вторичном вале.
Накидным ключом «на 13» отворачиваем один болт и тринадцать гаек крепления картера коробки передач к картеру сцепления.
Вставив в паз на стыке приваленных плоскостей картеров отвертку, аккуратно приподнимаем картер коробки передач…
…и снимаем его.
Вынимаем из углубления картера сцепления магнит.
Накидным ключом «на 10» отворачиваем болт крепления вилки включения I-II передач к штоку.
Приподнимаем шток вверх и выводим вилку из проточки скользящей муфты синхронизатора.
Накидным ключом «на 10» отворачиваем болт крепления вилки включения III-IV передач к штоку…
…и отверткой выводим рычаг штока из зацепления в механизме переключения передач.
Поднимаем шток вверх и выводим вилку из проточки скользящей муфты синхронизатора.
Поворачивая шток вилки включения V передачи, выводим рычаг штока из зацепления в механизме переключения передач.
Вынимаем ось промежуточной шестерни передачи заднего хода.
Вынимаем промежуточную шестерню передачи заднего хода.
Головкой «на 10» отворачиваем три болта крепления механизма переключения передач…
…и снимаем его.
Вынимаем одновременно первичный и вторичный валы из роликовых подшипников картера сцепления.
Вынимаем дифференциал в сборе.
Карданный шарнир штока переключателя передач можно заменить на автомобиле (не демонтируя коробку передач), отсоединив от хвостовика шарнира тягу управления коробкой передач . Для наглядности операции по снятию шарнира показываем на демонтированной коробке передач Сдвигаем защитный резиновый чехол с шарнира штока…
…и головкой «на 10» отворачиваем конический винт шарнира.
Снимаем со штока шарнир …
…и защитный чехол шарнира.
Если требуется снять переключатель передач или его шток…
…головкой «на 10» отворачиваем конический винт крепления переключателя передач.
Выдвигая шток из отверстия картера..
Отверткой извлекаем из сепаратора ролики переднего подшипника вторичного вала.
Вынимаем сепаратор подшипника.
Зацепив крючком ударного съемника буртик наружного кольца подшипника…
…выпрессовываем наружное кольцо подшипника.
Извлекаем маслосборник.
Таким же образом выпрессовываем наружное кольцо подшипника первичного вала.
Подходящим отрезком трубы выбиваем из картера сцепления…
…сальник привода колеса.
Через бородок наносим удары в торец наружного кольца подшипника дифференциала…
…и выпрессовываем кольцо.
Таким же образом выбиваем сальник и наружное кольцо подшипника дифференциала из картера коробки передач. Вынимаем регулировочное кольцо.
Дребезг рычага КПП на Лада Калина
Наверно у каждого владельца Лада Калина при разгоне на 3-ей передачи появлялся неприятный дребезг рычага КПП. В основном дребезг начинается когда обороты за 3000 или при торможении двигателем. Опытные водители нашли причину и методы её устранения. В данной статье мы расскажем как просто устранить дребезг рычага коробки передач на калине.
В основном дребезг начинается когда обороты за 3000 или при торможении двигателем. Опытные водители нашли причину и методы её устранения. В данной статье мы расскажем как просто устранить дребезг рычага коробки передач на калине.
Напомню, что в предыдущей статье мы рассматривали установку колодок на калину своими руками. Не каждый автомобиль оснащен аудио-системой, поэтому владельцы, которые приобрели такой автомобиль со временем приступают к самостоятельной установки.
На самом деле существует много способов, успешных и не очень. Кто-то мотает изоленту (сам так делал), кому-то помогает обильная смазка, видел даже пружинку кто-то использует!
Для устранения дребезга необходимо снять чехол кпп — просто поддеть вверх.
Изолента не помогла!
Вот где причина дребезга кпп на высоких оборотах. Проблема во втулке под номером 19.
Отворачиваем гайку справа. Нужен ключ на 13.
Достаем болт со всем, что на нем, вот примерно такая конструкция.
Вот что остается от рычага коробки передач Лада Калина.
Вся проблема во втулке, она длиннее чем нужно и из-за этого во всем этом бутерброде присутствует зазор, из-за которого и появляется дребезг ручки кпп на калине.
Втулка на фото в центре. Теперь измеряем длину втулки.
Длина примерно 10,6 мм. Нужно укоротить втулку примерно на 0,3 мм.
Сделать это можно напильником за пару минут! Я делал в 2 этапа, сначала сточил маленько, собрал проверил, потом сточил еще!
Перед сборкой все обильно смазываем смазкой.
Смазки мало не бывает. Собираем всю конструкцию и контрим гайку второй, чтобы не отворачивалась.
Справа вторая гайка.
Вот что получается в итоге, смазку еще и вниз добавил.
Если все сделать правильно, то рычаг должен стать совсем немного туже, мне это даже понравилось, а то больно сильно болтался. Дребезки на высоких передачах пропали полностью!
Замена шарнира реактивной тяги КПП Лада Калина своими руками
Шарнир реактивной тяги — является частью системы привода коробки переключения передач. Данная деталь необходима для гашения вибраций, поступающих от КПП, а также исключения различных стуков.
Данная деталь необходима для гашения вибраций, поступающих от КПП, а также исключения различных стуков.
Кроме того, шарнир реактивной тяги КПП не позволяет передачам произвольно переключаться во время движения автомобиля. В процессе эксплуатации данная деталь нередко изнашивается, в результате чего передачи включаются с затруднением, появляются посторонние стуки, а также дребезг рычага переключения передач. Решение данного вопроса довольно тривиальное — производится полная замена шарнира реактивной тяги КПП, после чего все встает на свои места.
В этой статье постараюсь максимально доступно рассказать о том, как заменить шарнир реактивной тяги КПП на Лада Калина в домашних условиях. Кроме того, дополню рассказ информативными фото для того, чтобы вы могли повторить то же самое у себя дома, сэкономив при этом на услугах СТО.
К сожалению, как и большинство деталей, которые устанавливает АвтоВАЗ на свои авто, шарниры реактивной тяги КПП также не отличаются надежностью, поэтому довольно быстро приходит в негодность, а также доставляет массу хлопот своему владельцу. Те, кто решил заменить заводской шарнир реактивной тяги КПП, несмотря на его исправность отмечали существенное улучшение четкости переключения передач, а также снижение вибрации, поступающей на рычаг КПП.
Замена шарнира реактивной тяги коробки переключения передач Лада Калина
Для работы потребуется наличие: торцевого и накидного на «13», а также ключа на «19» и нового шарнира реактивной тяги. Работу выполняем на «яме» или на подъемнике.
Теперь непосредственно о том, как заменить шарнир реактивной тяги КПП Калина
- Лезем под машину, демонтируем защиту картера, если она мешает.
- Обрабатываем гайки, которые будем откручивать жидкостью WD-40. Это упростит процесс откручивания гаек.
- Затем, используя подготовленные ключи, откручиваем гайку крепления хомута реактивной тяги, после чего откручиваем болт крепления самой реактивной тяги.

- Аккуратно извлекаем шарнир реактивной тяги, не теряя при этом шайбы и гравера.
- Производим замену неисправной детали, после чего фиксируем все в обратном порядке. В некоторых случаях может потребоваться регулировка, ее лучше выполнять с напарником. Сложного нет ничего, смысл заключается в том, чтобы найти оптимальное положение шарнира реактивной тяги путем проверки точности переключения передач. Регулировка выполняется на месте.
Собственно, и все. На все про все у вас уйдет порядка 30-50 минут, в зависимости от умения и состояния резьбовых соединений. У меня все, пишите ваши комментарии о том какой шарнир реактивной тяги купить лучше и каким образом на ваш взгляд можно добиться идеального переключения передач. Делитесь данной статьей со своими друзьями в социальных сетях, используя для этого специальные кнопки, буду весьма признателен.
У меня все, до новых встреч на ВАЗ Ремонт. Пока!
Фото отсюда: https://www.drive2.ru/l/9836591/
 Ремонт коробки передач уаз 469 своими руками
УАЗ 469. Ремонт КПП. Часть 1Особенности разборки полу-синхронизированной коробки передач. Частичная дефектовка. Поддержать проек.
УАЗ” 469. Ремонт КПП. Часть 2. Сборка
Последовательность сборки КПП УАЗ. Поддержать проект Группа Автознахарь .
18 февраля 1974 года с конвейера прибыло миллион UAZ-452 (в задней части фургона), который к тому времени приобрел большую популярность среди автомобилистов.
16 февраля 1976 года был отмечен награждением Ульяновского автомобильного завода вторым орденом Трудового Красного Знамени. 27 декабря того же года Государственный знак качества был награжден автомобильным двигателем UMZ-451M, а в ноябре 1977 года. фургоном УАЗ-452.
В 1983 году группа дизайнеров УАЗ получила правительственные награды за изобретение плавучего автомобиля Jaguar. Эта модель была предназначена для армии, в частности для пограничников. До сих пор в мире нет аналогов этого автомобиля: его скорость на воде составляет 8-10 км / ч.
Эта модель была предназначена для армии, в частности для пограничников. До сих пор в мире нет аналогов этого автомобиля: его скорость на воде составляет 8-10 км / ч.
В 1992 году, после развала СССР, УАЗ был преобразован в АООТ «Ульяновский автомобильный завод» (ОАО «УАЗ»). И уже в 1993 году завод начал выпускать автомобили новой модификации УАЗ-31514. Эта модификация автомобиля УАЗ-469 с повышенными потребительскими качествами отличалась наличием металлической крыши, регулируемых сидений, новых дверных замков. Расширение ряда модификаций включало завершение работы УАЗ-31514 с новыми, более экономичными двигателями и подпружиненной передней подвеской.
В октябре 1994 года завод получил международную премию «Золотой глобус» за выдающийся вклад в развитие своей экономики и интеграцию в мировую экономику, а также за конкурентоспособные и высококачественные продукты. В 1996 году по объемам продаж компания получила европейскую премию «Золотой Меркурий».
В 1997 году УАЗ-3160 был награжден Малой золотой медалью и дипломом в Екатеринбурге на Международной выставке «Европа-Азия-Транзит». В то же время завод начал производство небольших серийных автомобилей (PAM). Ремонт собственных комплектов HIP. Первой моделью, разработанной здесь, был УАЗ-3153, который отличался от УАЗ-31514 расширенной базой. 5 августа того же года с конвейера вышла первая экспериментальная партия новых автомобилей УАЗ-3160. Этот автомобиль стал основой для развития автомобилей Симбир и УАЗ-3163.
В июне 1998 года УАЗ начал сбор автомобилей с дизельным двигателем УАЗ-31604. Планами завода стали появление ряда автомобилей на базе нового грузового шасси, которое включает в себя современный автобус, новый грузовик и новую версию сельскохозяйственного автомобиля.
Читайте так же
В 1999 году была завершена подготовка производства и начато серийное производство новых моделей на базе малотоннажных автомобилей УАЗ-39094 с пятиместной кабиной и металлической платформой, а 27 апреля 2000 года появился первый автомобиль УАЗ-3162 с конвейера.
12 октября того же года «Северсталь» приобрела большую долю на автозаводе. В то же время была завершена разработка многоцелевой конфигурации с малой тонкой массой, которая может вместить до 12 человек.
В сентябре 2001 года на VII Московской промышленной выставке-ярмарке УАЗ Симбир был награжден золотой медалью. В соответствии с программой развития дилерской сети ОАО «УАЗ» в 2001 году была сформирована сеть продавцов из более чем 100 организаций в России и ближнем зарубежье.
В августе 2002 года на VII Российском международном автосалоне пикап UAZ-23632 был признан «лучшим пикапом MIMS-2002» и получил диплом Гран-при.
В марте 2003 года во Вьетнаме был открыт сборочный завод для УАЗ. 26 марта 2003 года автомобиль УАЗ Симбир стал одним из победителей Всероссийской конкурсной программы «100 лучших товаров России» в 2002 году и получил право носить серебряный значок в течение двух лет. В апреле UAZ Simbir с двигателем ZMZ-409 был представлен на международной выставке в Шанхае. 20 ноября последний автомобиль UAZ-31512 (модификация УАЗ-469) вышел со сборочной линии автозавода, а за ним. первый УАЗ-Охотник.
4 марта 2004 года с главного конвейера спустился первый УАЗ-2360 (грузовик на базе 3160). Также в 2004 году была реализована программа для замены буквенно-цифровых обозначений моделей со звучными запоминающимися именами: все внедорожники с классическим дизайном кузова теперь называются UAZ Hunter.
С 17 августа 2005 года Ульяновский автомобильный завод начал массовое производство внедорожника УАЗ Патриот. Это первая принципиально новая модель современного комфортного внедорожника, разработанная на УАЗе за последние 30 лет. С этого года УАЗ активно работает над репозиционированием бренда, включая изменение лозунга компании и корпоративных цветов. При отображении логотипов и слоганов компании вместо бело-голубых палитр использовалось зелено-бежевое.
11 июля 2006 года компания «Северсталь-авто» запустила новый проект по сборке грузовиков ISUZU NQR71P грузоподъемностью 5 тонн на производственной площадке Ульяновского автомобильного завода.
В октябре 2006 года ОАО «Северсталь-авто» и английская компания Stadco договорились о создании совместного предприятия по организации тиснения продукции в особой экономической зоне «Алабуга» в Татарстане. В планы работы компании входит специализация по крупногабаритному и среднему тиснению для удовлетворения потребностей проектов сборки автомобилей «Северсталь-Авто» и, в частности, проект по организации производства коммерческих автомобилей Fiat Ducato.
В феврале 2008 года на заводе УАЗ, входящем в состав холдинга «Северсталь-авто», было запущено производство легких коммерческих автомобилей на базе внедорожника UAZ Patriot. Ремонт рудника своими руками Новая модель получила название UAZ Cargo в нескольких модификациях: с открытой грузовой платформой с высотой кузова 1,4 м, а также в качестве шасси для установки надстроек.
Более 60-летняя история Ульяновского автомобильного завода является лучшим показателем качества автомобилей и уверенности в бренде. Несмотря на трудные времена Великой Отечественной войны, несмотря на сложные периоды реструктуризации и распада СССР, завод сумел сохранить высокий уровень, который он поддерживал в любое время своего существования и развития, что подтверждается не только многочисленными наградами , но и доверием широкого круга автомобилистов во всем мире.
Falshfeyer, который завершает все японские автомобили, лучше, от греха далеко, выбрасывать. Он имеет длительный срок хранения, и всевозможные пиротехнические изделия, особенно те, которые опаздывают, обладают свойством самовозгорания, особенно когда они интересуются детьми
Оригинал статьи находится на сайте http://landrover.ajp.ru
Спасибо Александру Дорохову, за то, что он прислал мне множество снимков своей коробки. На примере этих снимков я и написал эту статью.
На этом снимке видна крышка с вилками переключения передач. Визуально я не заметил ни каких износов вилок! Но надо обязательно пошевелить руками вилки. Если они начинают болтаться на штоках – Значит надо открутить проволоку, фиксирующее их и затянуть болты покрепче! Так, что визуально они выглядят на ура.
Теперь заглянув во внутрь коробки. Можно только вздохнуть. Здесь даже щупа не надо, чтобы увидеть на сколько велик износ шестерёнки второй передачи иторцом вторичного вала в районе сцепных зубьев. В идеале должно быть 0,2мм. На поработавшей конечно немного больше. Но здесь хорошо видно, что зазор как минимум в 3,5мм. Такую шестерёнку только на выброс. Потому, что у неё сцепные зубья схватятся только на половину. Сравните сами длину зубьев и ширину люфта.
Когда первичный вал вынут осмотрим его. Синхронизатор уже ни на что не годен, так как у него забиты до тупизны направляющие зубья. Сцепные зубья уже хорошенько поработали. Снизу зубьев хорошо видны равномерные полоски выработки. А вот сверху, с другой стороны, хорошо видна ржавчина на дальней половине зуба. Это говорит о том, что муфта передач при сбросе газа становилась боком или её отжимало. Так, что и первичный вал на выброс вместе с синхронизатором.
Вынимаем муфту синхронизатора со ступицей. Визуально. Зубья четвёртой передачи у муфты выглядят превосходно. К сожалению не видно их боковой износ от зубьев первичного вала?
Интересно, стопорное кольцо само вылезло? Если да то значит стопорная канавка на вторичном валу разбилась на конус и кольцо под нагрузкой из него выдавило. Значить придётся идти к токарю и он аккуратненько эту калёную канавочку выпровняет ну очень крепким резцом. За кольцом видна дистанционная втулка или шайба, как вам угодно. Надо будет тут же у токаря на вал посадить новый подшипник, поставить в канавку назад стопорное кольцо и токарь тут же выточит вам новую дистанционную шайбу. Шайба должна быть такой толщены, чтобы села между подшипником и стопорным кольцом с лёгким натягом или не более 0,1мм в минусе. Хотя возможно в магазине продаются новые стопорные кольца и дистанционные втулки разной толщены. Во всяком случае для land Rover так оно и делается. Но я надеюсь, что стопорное кольцо сняли.
Здесь тоже я наблюдаю вроде как износ стенок. Если да! То значит надо ставить новую стопорную шайбу большей толщены. Но, если и ступица синхронизатора болтается на шлицах вала. То лучше всего вал поменять тоже! Хотя шлицы выглядят аккуратно и следов износа не наблюдается. Скорее всего вал в хорошем состоянии.
Если да! То значит надо ставить новую стопорную шайбу большей толщены. Но, если и ступица синхронизатора болтается на шлицах вала. То лучше всего вал поменять тоже! Хотя шлицы выглядят аккуратно и следов износа не наблюдается. Скорее всего вал в хорошем состоянии.
Дополнение к написанному:
Само стопорное кольцо может в канавке люфтить вдоль вала. Главное, чтобы когда на вал были посажены, шестерёнка третей передачи и муфта синхронизатора зазор между стопорным кольцом и муфтой синхронизатора был минимальный. То есть, чем больше зазор, тем больше болтаются на оси шестерёнка и муфта. Поэтому мы и добиваемся, что бы все шестерёнки и муфты имели минимально возможный люфт. В идеале от 0,1 и до 0,2мм. Хотя я собирал коробки у которых этот люфт составлял 0,5мм. Но чем меньше тем лучше. Если зазор между стопорной шайбой и ступицей синхронизатора больше миллиметра? Нужно поставить стопорную шайбу потолще. Или поступить сложнее если люфты не убираются, потому что шестерёнка третей передачи новая, а торец вала к которому она прижимается уже сильно изношен. Надо проточить немного этот торец на валу к которому прижимается шестерня. И поставить туда бронзовую шайбу толщиной 3. 4мм. такой толщины, что бы она выбрала всё гуляние шестерёнки 3 передачи на валу и поджала муфту синхронизатора до стопорного кольца.
Муфта и зубья обращённые к шестерёнке третей или четвёртой передачи выглядит неплохо. Кромки зубьев целые. Косых износов не наблюдаю. Но если шестерёнки меняются то и муфта автоматически меняется в сборе со ступицей. Хотя я бы отложил эту деталь в сборе со ступицей, на всякий случай в запас. А если денег действительно не хватает, то поставил бы её. Если всё правильно будет отрегулировано ничего не будет болтается и передачи до этого не выбивало. Не вижу криминала. Главное, что бы ступица на валу сидела плотно.
Тоже самое касается ступицы.
Синхронизатор на замену у него затуплены кромки зубьев. В этом случае они не будут соскальзывать в сторону когда через них пойдут зубья муфты, соответственно рычаг передач будет с некоторым затруднением включать передачу.
У шестерёнки третей передачи забиты зубья до тупизны, да ещё видны следы сколов. Включать третью передачу будет сложновато да и то через раз. Она не жилец! Только замена. Бывший владелец явно себя не утруждал, подождать пока синхронизаторы уравняют скорости вращения валов. Тем более, что Нигрол этому способствует.
А вот так она выглядит сзади. Дистанционная шайба которая стоит сзади сильно выработалась. Надо покупать новую шайбу желательно подогнав по размеру. В крайнем случае выточить новую из бронзы. У меня на Ладе как раз там и стоит бронзовая. Главное, что бы шестерёнка 3 передачи ёрзала на валу не более 0,2мм. И медная втулка стала уже выкрашиваться. Это значит, что шестерёнка просто болталась на валу. А ведь у неё допуск 0,06мм.
Теперь самое сложное. Да можно померить внутренний диаметр шестерёнки нутромером или диджетал штангельцыркулем. Потом померить шейку вала, отнять одно от другого и получить результат. Но к сожалению этот измерительный инструмент стоит дороже чем новый вал и намного! Поэтому могу предложить только два варианта.
1) Втулка на новой шестерёнке всё равно имеет уже готовый размер и вы с трудом способны что нибудь здесь изменить.
2) Теперь способ проверки биения валов во втулках. На пальцах. Причём в прямом смысле слова. Человеческая рука начинает ощущать биение деталей в районе 0,1мм. Ну так вот если вы ощущаете биение уже с ясным стуком. Значит биение уже в районе 0,2мм. и более.
Но самое главное здесь не биение шестерёнки на валу, а насколько велико гуляние шестерёнки по валу.
Шестеренка должна как можно меньше гулять от муфты включения 3 4ой передачи и до упорного торца на валу. В идеале 0,08. 0,2мм.
А шестеренка второй передачи вне конкуренций. Она до того выработалась, что выработка выжрала острые кромки сцепных зубьев. А это примерно с миллиметр. Значить шестерёнка шарахалась на вторичном валу не менее 3,5мм (вторая фотография) при допуске 0,2мм. Такую надо в музей!
Зубья на шестерёнке первой передачи тоже забиты, Так, что вторая передача включатся будет весьма проблематично.
Шестерёнка промежуточного вала имела не побитые зубья и не побитые шлицы. Как правило так всегда. Если, что нибуть не повредило зубья промежуточного вала то на валу, как правило, меняются только подшипники. Исключение – сильно повреждённые зубья задней передачи.
На шестерёнке задней передачи замяты зубья. Довольно таки частый дефект. Её тоже надо заменить, так как износ идет на конус, то шестерёнку может через некаторе время начать выбивать. Присмотритесь к большей шестерёнке – снизу видно лучше.
Ось на которой вращается шестерёнка задней передачи выглядит неплохо. Я правда и не помню, что бы её когда либо меняли.
А вот подшипник надо поменять так как у него уже наблюдается выработка. У роликовых подшипников главный признак: если ролик выпал из сепаратора значит подшипник выработал себя.
Судя по фотографиям. Из муфты синхронизаторов были удалены сухарики. Ни чего удивительного. При таком большом люфте шестерёнок (вдоль валов) сухарики муфты 3 и 4ой передачи, стали вылазить за муфту синхронизатора при включение передач. После чего они начинали под воздействием пружины топорщится наружу и в результате нельзя было выключить передачи. Именно, что бы этого и не происходило я и стараюсь выбрать при ремонте все люфты на валах коробки и вилок включения.
Вердикт. В коробке надо поменять шестерёнку 1,2,3, передачи. Так же заменить первичный вал, все подшипники, шестерёнку заднего хода. Не строго обязательно, но надо муфту со ступицей и оба синхронизатора. Если новые шестерёнки будут болтаться на старом валу более 0,15мм. (рука прекрасно ощущает стук выше 0,1мм.) Значит вторичный вал тоже заменить.
>
Выберите свое решение — iFixit EDU
Обучение ремонту — это развлечение, расширение возможностей и, что наиболее важно, спасение планеты, уберегая потребительские товары от свалок.
Конечная цель вашего проекта — создать руководство по ремонту, которое учит лучшим методам ремонта. Другими словами, быстрое исправление — это не «взлом» — ваше руководство должно быть подробным, эффективным и достойным документирования для реальных человек, а на самом деле используют .
Хорошее практическое правило состоит в том, что ваше руководство должно требовать шесть или более шагов (отдельные действия или инструкции).
Вот три выдающихся примера заполненных руководств:
Перед тем, как выбрать исправление , вместе со своей командой заполните Опись опыта ремонта. Собранная вами информация станет частью вашего предложения, поэтому не пропустите этот важный шаг!
В чем смысл инвентаризации? Мы рады, что вы спросили. Как мы любим говорить в iFixit, один человек не может все отремонтировать, но каждый знает, как что-то отремонтировать. Этот инвентарь поможет вам откопать секретные суперсилы ремонта и знания, похороненные внутри вас, вашей команды и вашего сообщества. Ваш проект будет более успешным, если вы выберете проект Fast Fix, который использует эти коллективные знания по ремонту.
Чтобы начать свой проект, выберите одну основную тему и две альтернативные темы , которые соответствуют вашему листу инвентаризации опыта ремонта. Эти темы быстрого исправления должны касаться физических предметов (а не программного обеспечения) в вашей жизни, которые вы хотели бы показать, как исправить, — желательно, что-то, что имеет простое решение (например, сломанный триггер, поцарапанный компакт-диск или протекающая раковина) . Главное требование — выбрать то, что еще не задокументировано в iFixit. Вам нужно будет использовать инструмент поиска, чтобы убедиться, что ваше исправление еще не задокументировано в iFixit.
Помните, что аудитория iFixit сосредоточена на ремонт , поэтому ваше руководство должно показать, как что-то исправить. В общем, вам следует избегать написания руководств только для чистки или смазки предметов, которые в остальном находятся в рабочем состоянии. (Мы не против процедур обслуживания , при условии, что это то, для чего реальным людям, вероятно, понадобится руководство, и что оно поможет предотвратить необходимость ремонта в будущем. )
)
Тем не менее, выбранный вами предмет не обязательно должен быть сломан . В приведенных выше примерах направляющие для записей и застежки-молнии не требовали наличия поврежденных предметов, чтобы показать правильную процедуру ремонта. С другой стороны, если вы хотите составить руководство по ремонту гипсокартона, вам, вероятно, понадобится поврежденный гипсокартон, чтобы показать, что ремонтируется. Используйте здравый смысл и тщательно спланируйте свое руководство.
Мы хотим, чтобы вы могли выбрать тему, которая действительно волнует вас и хорошо согласуется с вашими навыками, но мы должны убедиться, что ваша тема и процедура безопасны.Опять же, используйте здесь ваше здравое суждение. Запрещены следующие исправления:
Если вы не знаете, что исправить, подумайте над следующими вопросами:
Что вы хотели бы знать, как исправить?
Что было сломано в доме? Почему они вышли из строя и сколько стоило их заменить?
Без чего вы не могли бы жить?
Что выбросили? Почему?
Реакция на повреждение ДНК: расстановка контрольных точек в перспективе
Джордж, Дж., Castellazzi, M. & Buttin, G. Индукция профага и деление клеток в E. coli. III. Мутации sfiA и sfiB восстанавливают деление в штаммах tif и lon и позволяют проявлять мутаторные свойства tif. Мол. Genet Genet. 140 , 309–332 (1975).
CAS PubMed Google Scholar
Пейнтер, Р. Б. и Янг, Б. Р. Радиочувствительность при атаксии-телеангиэктазии: новое объяснение. Proc. Natl Acad. Sci. США 77 , 7315–7317 (1980).
ADS CAS PubMed PubMed Central Google Scholar
Weinert, T. A. & Hartwell, L.H. Ген RAD9 контролирует реакцию клеточного цикла на повреждение ДНК в Saccharomyces cerevisiae . Science 241 , 317–322 (1988).
Science 241 , 317–322 (1988).
ADS CAS Google Scholar
Кортез, Д., Wang, Y., Qin, J. & Elledge, S.J. Необходимость ATM-зависимого фосфорилирования brca1 в ответе на повреждение ДНК на двухцепочечные разрывы. Наука 286 , 1162–1166 (1999).
CAS PubMed PubMed Central Google Scholar
Lim, D. S. et al. ATM фосфорилирует p95 / nbs1 в пути контрольной точки S-фазы. Nature 404 , 613–617 (2000).
ADS CAS PubMed PubMed Central Google Scholar
Гати, М. et al. ATM-зависимое фосфорилирование нибрина в ответ на радиационное воздействие. Nature Genet. 25 , 115–119 (2000).
CAS Google Scholar
Zhao, S. et al. Функциональная связь между продуктами генов атаксии-телеангиэктазии и синдрома разрыва Неймегена. Природа 405 , 473– 477 (2000).
ADS CAS Google Scholar
Wu, X.и другие. ATM-фосфорилирование белка синдрома разрыва Неймегена необходимо в ответе на повреждение ДНК. Природа 405 , 477 — 482 (2000).
ADS CAS Google Scholar
Мартин, С. Г., Ларош, Т., Сука, Н., Грюнштейн, М. и Гассер, С. М. Перемещение теломерных белков Ku и SIR в ответ на разрывы цепи ДНК у дрожжей. Cell 97 , 621–633 (1999).
CAS PubMed PubMed Central Google Scholar
Миллс, К.Д., Синклер, Д. А. и Гуаренте, Л. MEC1-зависимое перераспределение белка сайленсинга Sir3 от теломер до двухцепочечных разрывов ДНК. Cell 97 , 609–620 (1999).
CAS PubMed Google Scholar
Элледж, С. Дж. Контрольные точки клеточного цикла: предотвращение кризиса идентичности. Наука 274 , 1664–1672 (1996).
Дж. Контрольные точки клеточного цикла: предотвращение кризиса идентичности. Наука 274 , 1664–1672 (1996).
ADS CAS Google Scholar
Найто, Т., Мацуура, А. и Исикава, Ф. Образование круговых хромосом у мутанта делящихся дрожжей, дефектных по двум гомологам ATM. Nature Genet. 20 , 203–206 (1998).
CAS PubMed Google Scholar
Ritchie, K. B., Mallory, J. C. & Petes, T. D. Взаимодействие TLC1 (который кодирует субъединицу РНК теломеразы), TEL1 и MEC1 в регулировании длины теломер в дрожжах Saccharomyces cerevisiae . Мол. Клетка. Биол. 19 , 6065–6075 (1999).
CAS PubMed PubMed Central Google Scholar
Lowe, S. W., Schmitt, E. M., Smith, S. W., Osborne, B. A. & Jacks, T. p53 необходим для радиационно-индуцированного апоптоза в тимоцитах мыши. Nature 362 , 847–849 (1993).
ADS CAS Google Scholar
Кларк, А.R. et al. Апоптоз тимоцитов, индуцированный р53-зависимыми и независимыми путями. Nature 362 , 849–852 (1993).
ADS CAS Google Scholar
Xu, Y. & Baltimore, D. Двойная роль ATM в клеточном ответе на радиацию и в контроле роста клеток. Genes Dev. 10 , 2401–2410 (1996).
CAS PubMed Google Scholar
Хирао, А. et al. Активация р53, вызванная повреждением ДНК, с помощью киназы контрольной точки Chk2. Наука 287 , 1824–1827 (2000).
ADS CAS Google Scholar
Brown, E. J. & Baltimore, D. Нарушение ATR приводит к фрагментации хромосом и ранней эмбриональной летальности. Genes Dev. 14 , 397–402 (2000).
Genes Dev. 14 , 397–402 (2000).
CAS PubMed PubMed Central Google Scholar
де Кляйн, А. et al. Направленное нарушение ATR гена контрольной точки клеточного цикла приводит к ранней эмбриональной летальности у мышей. Curr. Биол. 10 , 479–482 (2000).
CAS PubMed PubMed Central Google Scholar
Liu, Q. et al. Chk1 является важной киназой, которая регулируется Atr и необходима для контрольной точки повреждения ДНК G (2) / M. Genes Dev. 14 , 1448–1459 (2000).
CAS PubMed PubMed Central Google Scholar
Takai, H. et al. Аберрантная функция контрольной точки клеточного цикла и ранняя гибель эмбрионов у мышей Chk1 (- / -). Genes Dev. 14 , 1439–1447 (2000).
CAS PubMed PubMed Central Google Scholar
Ротман, Г. и Шайло, Ю. Атаксия-телеангиэктазия: является ли банкомат датчиком окислительного повреждения и стресса? BioEssays 19 , 911–917 (1997).
CAS PubMed Google Scholar
Sun, Z., Hsiao, J., Fay, D. S. & Stern, D. F. FHA-домен Rad53, связанный с фосфорилированным Rad9 в контрольной точке повреждения ДНК. Наука 281 , 272–274 (1998).
ADS CAS Google Scholar
Эмили, А. MEC1-зависимое фосфорилирование Rad9p в ответ на повреждение ДНК. Мол. Ячейка 2 , 183– 189. (1998).
CAS Google Scholar
Vialard, J. E., Gilbert, C. S., Green, C. M. & Lowndes, N. F. Белок контрольной точки Rad9 почкующихся дрожжей подвергается Mec1 / Tel1-зависимому гиперфосфорилированию и взаимодействует с Rad53 после повреждения ДНК. EMBO J. 17 , 5678–5688 (1998).
EMBO J. 17 , 5678–5688 (1998).
Google Scholar
Санчес, Ю. et al. Контроль контрольной точки повреждения ДНК протеинкиназами chk1 и rad53 с помощью различных механизмов. Наука 286 , 1166–1171 (1999).
CAS PubMed PubMed Central Google Scholar
Durocher, D., Henckel, J., Fersht, A.R., Jackson, S.P. Домен FHA представляет собой модульный мотив распознавания фосфопептидов. Мол. Ячейка 4 , 387–394 (1999).
CAS PubMed PubMed Central Google Scholar
Liao, H., Byeon, I. J. & Tsai, M. D. Структура и функция нового фосфопептид-связывающего домена, содержащего FHA2 Rad53. J. Mol. Биол. 294 , 1041–1049 (1999).
CAS PubMed Google Scholar
Wang, Z. Q. et al. Мыши, лишенные ADPRT и поли (ADP-рибозилирования), развиваются нормально, но подвержены кожным заболеваниям. Genes Dev. 9 , 509–520 (1995).
CAS PubMed Google Scholar
Jimenez, G. S. et al. ДНК-зависимая протеинкиназа не требуется для р53-зависимого ответа на повреждение ДНК. Nature 400 , 81–83 (1999).
ADS CAS PubMed Google Scholar
О’Коннелл, М. Дж., Уолворт, Н. С. и Карр, А. М. Контрольная точка повреждения ДНК в фазе G2. Trends Cell Biol. 10 , 296–303 (2000).
CAS Google Scholar
Volkmer, E. & Karnitz, L.M. Человеческие гомологи Schizosaccharomyces pombe rad1, hus1 и rad9 образуют белковый комплекс, чувствительный к повреждению ДНК. J. Biol. Chem. 274 , 567–570 (1999).
CAS PubMed Google Scholar
Вайс, Р.С., Энох, Т. и Ледер, П. Инактивация мышиного Hus1 приводит к геномной нестабильности и нарушению реакции на генотоксический стресс. Genes Dev. 14 , 1886–1898 (2000).
CAS PubMed PubMed Central Google Scholar
Sugimoto, K., Ando, S., Shimomura, T. & Matsumoto, K. Rfc5, компонент фактора репликации C, необходим для регуляции протеинкиназы Rad53 в пути контрольных точек дрожжей. Мол. Клетка. Биол. 17 , 5905–5914 (1996).
Google Scholar
Носков В. Н., Араки Х. и Сугино А. Ген RFC2, кодирующий третью по величине субъединицу комплекса фактора репликации C, необходим для контрольной точки S-фазы в Saccharomyces cerevisiae . Мол. Клетка. Биол. 18 , 4914–4923 (1998).
CAS PubMed PubMed Central Google Scholar
Шимомура Т., Андо, С., Мацумото, К. и Сугимото, К. Функциональное и физическое взаимодействие между Rad24 и Rfc5 в путях контрольных точек дрожжей. Мол. Клетка. Биол. 18 , 5485– 5491 (1998).
CAS PubMed PubMed Central Google Scholar
Shimada, M. et al. Фактор C3 репликации Schizosaccharomyces pombe , небольшая субъединица комплекса фактора репликации C, играет роль как в контрольных точках репликации, так и в повреждениях. Мол. Биол. Ячейка 10 , 3991–4003 (1999).
CAS PubMed PubMed Central Google Scholar
Грин, К. М., Эрдджумент-Бромаж, Х., Темпст, П. и Лаундс, Н. Ф. Новый белковый комплекс контрольной точки Rad24, тесно связанный с фактором репликации С. Curr. Биол. 10 , 39–42 (2000).
CAS PubMed Google Scholar
Эдвардс, Р.Дж., Бентли, Н. Дж. И Карр, А. М. Комплекс Rad3-Rad26 реагирует на повреждение ДНК независимо от других белков контрольной точки. Nature Cell Biol. 1 , 393–398 (1999).
CAS Google Scholar
Paciotti, V., Clerici, M., Lucchini, G. & Longhese, MP Белок контрольной точки Ddc2, функционально связанный с S. pombe Rad26, взаимодействует с Mec1 и регулируется Mec1-зависимым фосфорилированием в бутоньерки. Genes Dev. 14 , 2046–2059 (2000).
CAS PubMed PubMed Central Google Scholar
Rouse, J. & Jackson, S. P. LCD1: важный ген, участвующий в контроле контрольных точек и регуляции сигнального пути MEC1 в Saccharomyces cerevisiae . EMBO J. 19 , 5801–5812 (2000).
CAS PubMed PubMed Central Google Scholar
Сюй, Х.и другие. Амплификация центросом и дефектная контрольная точка клеточного цикла G2-M вызывают генетическую нестабильность в клетках с дефицитом изоформы 11 экзона BRCA1. Мол. Ячейка 3 , 389–395 (1999).
CAS PubMed Google Scholar
Wang, Y. et al. BASC, суперкомплекс BRCA1-ассоциированных белков, участвующих в распознавании и восстановлении аберрантных структур ДНК. Genes Dev. 14 , 927–939 (2000).
CAS PubMed PubMed Central Google Scholar
Gong, J. G. et al. Тирозинкиназа c-Abl регулирует p73 в апоптотическом ответе на цисплатин-индуцированное повреждение ДНК. Nature 399 , 806–809 (1999).
ADS CAS Google Scholar
Кастан, М. Б. и др. Путь контрольной точки клеточного цикла млекопитающих, использующий p53 и GADD45, является дефектным при атаксии-телеангиэктазии. Cell 71 , 587–597 (1992).
Б. и др. Путь контрольной точки клеточного цикла млекопитающих, использующий p53 и GADD45, является дефектным при атаксии-телеангиэктазии. Cell 71 , 587–597 (1992).
CAS Google Scholar
Paules, R. S. et al. Нарушение функции контрольной точки G2 в клетках лиц с синдромами семейного рака. Cancer Res. 55 , 1763–1773 (1995).
CAS PubMed Google Scholar
Cliby, W. A. et al. Сверхэкспрессия киназно-неактивного белка ATR вызывает чувствительность к агентам, повреждающим ДНК, и дефекты в контрольных точках клеточного цикла. EMBO J. 17 , 159–169 (1998).
CAS PubMed PubMed Central Google Scholar
Райт, Дж. А. и др. Мутанты протеинкиназы человеческого ATR повышают чувствительность к УФ и ионизирующему излучению и отменяют контроль контрольных точек клеточного цикла. Proc. Natl Acad. Sci. США 95 , 7445–7450 (1998).
ADS CAS PubMed Google Scholar
Ким, С.Т., Лим, Д. С., Канман, К. Э. и Кастан, М. Б. Специфичность субстрата и идентификация предполагаемых субстратов членов семейства киназ ATM. J. Biol. Chem. 274 , 37538 — 37543 (1999).
CAS PubMed Google Scholar
Canman, C.E. et al. Активация киназы ATM ионизирующим излучением и фосфорилированием p53. Наука 281 , 1677–1679 (1998).
ADS CAS Google Scholar
Банин, С. и др. Усиленное фосфорилирование p53 ATM в ответ на повреждение ДНК. Наука 281 , 1674–1677 (1998).
ADS CAS Google Scholar
Tibbetts, R. S. et al. Роль ATR в фосфорилировании р53, вызванном повреждением ДНК. Genes Dev. 13 , 152–157 (1999).
S. et al. Роль ATR в фосфорилировании р53, вызванном повреждением ДНК. Genes Dev. 13 , 152–157 (1999).
CAS PubMed PubMed Central Google Scholar
Tibbetts, R. S. et al. Функциональные взаимодействия между BRCA1 и контрольной киназой ATR во время генотоксического стресса. Genes Dev. (в печати).
Barlow, C. et al. Atm-дефицитные мыши: парадигма атаксии телеангиэктазии. Cell 86 , 159–171 (1996).
CAS PubMed PubMed Central Google Scholar
Elson, A. et al. Плейотропные дефекты у мышей с дефицитом белка при атаксии-телеангиэктазии. Proc. Natl Acad. Sci. США 93 , 13084 — 13089 (1996).
ADS CAS PubMed PubMed Central Google Scholar
Десани, Б.А., Алькасабас, А.А., Бачант, Дж.Б. и Элледж, С. Дж. Восстановление после репликационного стресса ДНК является важной функцией пути контрольной точки S-фазы. Genes Dev. 12 , 2956–2970 (1998).
CAS PubMed PubMed Central Google Scholar
Khanna, K. K. et al. ATM связывает и фосфорилирует p53: картирование области взаимодействия. Nature Genet. 20 , 398–400 (1998).
CAS PubMed Google Scholar
Chan, D. W. et al. Очистка и характеристика ATM из плаценты человека. Марганец-зависимая, чувствительная к вортманнину серин / треониновая протеинкиназа. J. Biol. Chem. 275 , 7803–7810 (2000).
CAS PubMed Google Scholar
Smith, G.C. et al. Очистка и свойства связывания ДНК продукта гена атаксии-телеангиэктазии ATM. Proc. Natl Acad. Sci. USA 96 , 11134–11139 (1999).
Proc. Natl Acad. Sci. USA 96 , 11134–11139 (1999).
ADS CAS PubMed Google Scholar
Лакин, Н. Д., Ханн, Б. С. и Джексон, С. П. Белок, связанный с атаксией-телеангиэктазией, ATR опосредует ДНК-зависимое фосфорилирование р53. Онкоген 18 , 3989–3995 (1999).
CAS PubMed Google Scholar
Холл-Джексон, К.A., Cross, D. A., Morrice, N. & Smythe, C. ATR представляет собой чувствительную к кофеину ДНК-активированную протеинкиназу с субстратной специфичностью, отличной от ДНК-PK. Онкоген 18 , 6707–6713 (1999).
CAS PubMed Google Scholar
Мацуока С., Хуанг М. и Элледж С. Дж. Связь ATM с регуляцией клеточного цикла протеинкиназой Chk2. Наука 282 , 1893–1897 (1998).
ADS CAS PubMed PubMed Central Google Scholar
Blasina, A. et al. Человеческий гомолог киназы контрольной точки Cds1 непосредственно ингибирует фосфатазу Cdc25. Curr. Биол. 9 , 1–10 (1999).
CAS PubMed Google Scholar
Brown, A. L. et al. Cds1-родственная киназа человека, которая функционирует ниже белка ATM в клеточном ответе на повреждение ДНК. Proc. Natl Acad. Sci. США 96 , 3745–3750 (1999).
ADS CAS Google Scholar
Chaturvedi, P. et al. Chk2 млекопитающих является нижестоящим эффектором ATM-зависимого пути контрольной точки повреждения ДНК. Онкоген 18 , 4047– 4054 (1999).
CAS PubMed PubMed Central Google Scholar
Чжоу, Б.-B. S. et al. Кофеин устраняет контрольную точку повреждения ДНК G2 / M млекопитающих, ингибируя активность киназной мутации, вызванной атаксией-телеангиэктазией. J. Biol. Chem. 275 , 10342– 10348 (2000).
Кофеин устраняет контрольную точку повреждения ДНК G2 / M млекопитающих, ингибируя активность киназной мутации, вызванной атаксией-телеангиэктазией. J. Biol. Chem. 275 , 10342– 10348 (2000).
CAS Google Scholar
Мацуока, С. и др. . ATM фосфорилирует Chk2 in vivo и in vitro. Proc. Natl Acad. Sci. USA 97 , 10389–10394 (2000).
ADS CAS PubMed PubMed Central Google Scholar
Мельчионна, Р., Chen, X., Blasina, A. & McGowan, C.H. Треонин 68 необходим для радиационно-индуцированного фосфорилирования и активации Cds1. Nature Cell Biol. 2 , 762–765 (2000).
CAS PubMed PubMed Central Google Scholar
Chehab, N.H., Malikzay, A., Appel, M. & Halazonetis, T. D. Chk2 / hCds1 функционирует как контрольная точка повреждения ДНК в G (1), стабилизируя p53. Genes Dev. 14 , 278–288 (2000).
CAS PubMed PubMed Central Google Scholar
Shieh, S. Y., Ahn, J., Tamai, K., Taya, Y. & Prives, C. Человеческие гомологи киназ контрольной точки Chk1 и Cds1 (Chk2) фосфорилируют p53 по множественным сайтам, индуцируемым повреждением ДНК. Genes Dev. 14 , 289–300 (2000).
CAS PubMed PubMed Central Google Scholar
Чехаб, Н.Х., Маликзай А., Ставриди Э. С. и Халазонетис Т. Д. Фосфорилирование Ser-20 опосредует стабилизацию человеческого p53 в ответ на повреждение ДНК. Proc. Natl Acad. Sci. USA 96 , 13777–13782 (1999).
ADS CAS PubMed PubMed Central Google Scholar
Эшкрофт, М., Куббутат, М. Х. и Вусден, К. Х. Регулирование функции и стабильности р53 путем фосфорилирования. Мол. Клетка.Биол. 19 , 1751–1758 (1999).
Мол. Клетка.Биол. 19 , 1751–1758 (1999).
CAS PubMed PubMed Central Google Scholar
Khosravi, R. et al. Быстрое ATM-зависимое фосфорилирование MDM2 предшествует накоплению p53 в ответ на повреждение ДНК. Proc. Natl Acad. Sci. USA 96 , 14973–14977 (1999).
ADS CAS Google Scholar
Белл, Д.W. et al. Гетерозиготная зародышевая линия hCHK2 мутации при синдроме Ли-Фраумени. Наука 286 , 2528–2531 (1999).
CAS Google Scholar
Ли, Дж. С., Коллинз, К. М., Браун, А. Л., Ли, К. Х. и Чанг, Дж. Х. hCds1-опосредованное фосфорилирование BRCA1 регулирует ответ на повреждение ДНК. Nature 404 , 201–204 (2000).
ADS CAS PubMed PubMed Central Google Scholar
Санчес, Ю. et al. Консервация пути контрольной точки Chk1 у млекопитающих: связь повреждения ДНК с регуляцией Cdk через Cdc25. Science 277 , 1497–1501 (1997).
CAS PubMed Google Scholar
Уолворт, Н. С. и Бернардс, Р. Рад-зависимый ответ кодируемой chk1 протеинкиназы в контрольной точке повреждения ДНК. Наука 271 , 353–356 (1996).
ADS CAS Google Scholar
Медсестра, П.Пути КПП достигли совершеннолетия. Cell 91 , 865–867 (1997).
CAS PubMed Google Scholar
Морган Д.О. Принципы регулирования CDK. Nature 374 , 131–134 (1995).
ADS CAS PubMed Google Scholar
Peng, C. Y. et al. Контроль контрольных точек митоза и G2: регулирование связывания белка 14-3-3 путем фосфорилирования Cdc25C по серину-216. Наука 277 , 1501–1505 (1997).
Y. et al. Контроль контрольных точек митоза и G2: регулирование связывания белка 14-3-3 путем фосфорилирования Cdc25C по серину-216. Наука 277 , 1501–1505 (1997).
CAS Google Scholar
Dalal, S. N., Schweitzer, C. M., Gan, J. & DeCaprio, J. A. Цитоплазматическая локализация человеческого cdc25C во время интерфазы требует интактного сайта связывания 14-3-3. Мол. Клетка. Биол. 19 , 4465–4479 (1999).
CAS PubMed PubMed Central Google Scholar
Ян Дж., Винклер, К., Йошида, М. и Корнблут, С. Поддержание ареста G2 в ооците Xenopus : роль 14-3-3-опосредованного ингибирования ядерного импорта Cdc25. EMBO J. 18 , 2174 — 2183 (1999).
CAS PubMed PubMed Central Google Scholar
Bunz, F. et al. Требование к p53 и p21 для поддержания остановки G2 после повреждения ДНК. Наука 282 , 1497–1501 (1998).
CAS PubMed PubMed Central Google Scholar
Чан, Т. А., Хермекинг, Х., Ленгауэр, К., Кинзлер, К. В. и Фогельштейн, Б. 14-3-3 Сигма необходима для предотвращения митотической катастрофы после повреждения ДНК. Nature 401 , 616–620 (1999).
ADS CAS Google Scholar
Джелински С.А. и Самсон Л.Д. Глобальный ответ Saccharomyces cerevisiae на алкилирующий агент. Proc. Natl Acad. Sci. США 96 , 1486–1491 (1999).
ADS CAS Google Scholar
Hwang, B.J., Ford, J.M., Hanawalt, P.C. & Chu, G. Экспрессия гена p48 xeroderma pigmentosum зависит от p53 и участвует в глобальной репарации генома. Proc. Natl Acad. Sci. США 96 , 424–428 (1999).
ADS CAS PubMed Google Scholar
Танака, Х. et al. Ген рибонуклеотидредуктазы, вовлеченный в p53-зависимую контрольную точку клеточного цикла для повреждения ДНК. Nature 404 , 42–49 (2000).
ADS CAS Google Scholar
Карни, Дж. П. и др. Белковый комплекс hMre11 / hRad50 и синдром разрыва Неймегена: связь репарации двухцепочечных разрывов с ответом на повреждение клеточной ДНК. Cell 93 , 477–486 (1998).
CAS Google Scholar
Stewart, G. S. et al. Ген репарации двухцепочечных разрывов ДНК hMRE11 мутирован у людей с заболеванием, подобным атаксии-телеангиэктазии. Ячейка 99 , 577–587 (1999).
CAS Google Scholar
Джегго, П. А., Карр, А. М. и Леманн, А. Р. Разделение банкомата: отдельные дефекты ремонта и контрольных точек при атаксии-телеангиэктазии. Trends Genet. 14 , 312–316 (1998).
CAS PubMed Google Scholar
Мойнахан, М. Э., Чиу, Дж. У., Коллер, Б. Х. и Джасин, М. Brca1 контролирует гомологически направленную репарацию ДНК. Мол. Ячейка 4 , 511–518 (1999).
CAS Google Scholar
Башкиров В.И., Кинг Ю.С., Башкирова Е.В., Шмукли-Маурер Ю.& Heyer, W. D. Белок репарации ДНК Rad55 является конечным субстратом контрольных точек повреждения ДНК. Мол. Клетка. Биол. 20 , 4393–4404 (2000).
CAS PubMed PubMed Central Google Scholar
Brush, G. S., Morrow, D. M., Hieter, P. & Kelly, T. J. Гомолог ATM MEC1 необходим для фосфорилирования репликационного белка A в дрожжах. Proc. Natl Acad. Sci. USA 93 , 15075–15080 (1996).
Proc. Natl Acad. Sci. USA 93 , 15075–15080 (1996).
ADS CAS PubMed Google Scholar
Lydall, D. & Weinert, T. Гены контрольных точек дрожжей в обработке повреждений ДНК: последствия для восстановления и остановки. Наука 270 , 1488–1491 (1995).
ADS CAS PubMed Google Scholar
Bochar, D. A. et al. BRCA1 связан с человеческим комплексом SWI / SNF: связывая ремоделирование хроматина с раком груди. Ячейка 102 , 257–265 (2000).
CAS Google Scholar
Гассер С.М. Чувство конца. Наука 288 , 1377–1379 (2000).
ADS CAS PubMed Google Scholar
причин, почему инфляция в шинах так важна на mjscompleteauto.com
Проблема может возникнуть даже из-за недостаточного накачивания шин на фунт или два.Но почему? Причин несколько.
Экономия топлива: Если вы когда-либо ездили на велосипеде с низкой шиной, вы знаете, что из-за дополнительного сопротивления качению создается ощущение, что вы едете по мокрому цементу. То же самое происходит с вашим автомобилем и снижает расход топлива. На протяжении 10 000 миль в год это может добавить до 150 галлонов бензина или 500 долларов из вашего кармана!
Управляемость: Низкое давление в шинах означает плохой контроль и более длинный тормозной путь.В частности, на высоких скоростях это может быть совершенно опасно.
Преждевременный износ шин: Недокачанные шины испытывают большие нагрузки, особенно их стальные ремни. Возьмите скрепку и вращайте ею взад и вперед, пока она не сломается. Почувствуйте, насколько сильно нагревается металл? То же самое происходит со стальными ремнями в ваших шинах, которые в любом случае уже нагреваются из-за нормального износа. Это тепло и напряжение вызовут неравномерный износ протектора и даже могут привести к полному выходу шин из строя.
Это тепло и напряжение вызовут неравномерный износ протектора и даже могут привести к полному выходу шин из строя.
Правильная накачка шин может повысить экономию топлива на 3,3% или даже больше. Помните, что вы не сможете обнаружить низкое давление воздуха, глядя на шину, пока оно не станет действительно низким (ниже 20 фунтов на квадратный дюйм или около того). Помните также, что воздух будет выходить из шины через шток клапана и боковины шины только в результате нормального износа; Вам следует приобрести качественный шиномер (не тот, который встроен в шланг на заправке) и проверять давление в шинах не реже одного раза в месяц.В горячем воздухе воздух расширяется, поэтому не забывайте проверять давление в шинах, когда они еще холодные.
Давление в шинах не является приоритетом для большинства водителей, но все же важно. Необходимость заменить преждевременно изношенные шины или залить больше бензина в топливный бак кажется довольно глупым способом тратить деньги, не так ли? Сделайте себе одолжение и помните об уровне накачивания шин!
Программа обеспечения удовлетворенности| Недвижимость Meld
Процесс поддержания качества означает, что жители будут счастливее.Более счастливые жители улучшают отзывы и удерживают постоянных жителей. Положительные отзывы и удержание резидентов приводят к увеличению доходов и уменьшению текучести кадров. Это довольно простая математика.
Задача
Уверенно зная, что ваш процесс готов. С этой целью мы рассмотрели, как могут выглядеть процессы обслуживания, чтобы определить, как они должны выглядеть. Вот что мы нашли.
В нашем анализе рабочий процесс любого запроса на обслуживание состоит из нескольких основных этапов:
Получение запроса на техническое обслуживание
Координация графиков технического обслуживания и резидента
Технического специалиста по диспетчеризации
Последующее наблюдение за техническим специалистом и резидентом по составлению графика ремонта
Проверка выполнения работ
Получение резидентского обзора
Мы обнаружили, что независимо от того, обрабатывается ли это внутренне или внешне, процессы практически идентичны. Вопросы, на которые оба процесса должны стремиться ответить, тоже есть.
Вопросы, на которые оба процесса должны стремиться ответить, тоже есть.
Получил ли техник заказ на работу?
Собираются ли они устроиться на работу?
Дошли ли они до резидента?
Было ли запланировано время?
Ремонт закончен?
Удовлетворен ли проживающий?
Сходство между внутренними и внешними процессами может означать, что легко переходить между одним и другим. Но в этой простоте использования есть одна загвоздка: ремонтные работы могут «провалиться» в любой системе.Итак, как создать последовательный и успешный процесс, позволяющий избежать дорогостоящих ошибок? Вот несколько советов.
Контрольно-пропускные пункты
Создание пошагового процесса отслеживания ремонта — отличный ход. Но в конечном итоге бесполезно, если вы не подтверждаете или не можете подтвердить, что эти шаги выполняются своевременно и эффективно. Таким образом, одна из наиболее важных концепций успешного процесса технического обслуживания — это проверка соблюдения важных контрольных точек.
Первая контрольная точка, которую ваш процесс должен проверить, — это то, что задание было получено и принято техническим специалистом. Следующим шагом будет подтверждение того, что резидент и технический специалист назначили встречу.
В идеальном мире этот этап автоматизирован с помощью программного обеспечения Meld, где управляющие недвижимостью могут легко перейти на свою панель управления и увидеть, где выполняется каждое ремонтное задание.
Но независимо от того, как выполняется эта контрольная точка, мы рекомендуем вам не ждать более 24 часов после того, как технический специалист примет задание, прежде чем вы начнете регистрацию и убедитесь, что встреча назначена.Этот шаг также важен из-за следующей контрольной точки: проверка выполнения задания.
На этом этапе процесса вы должны знать, когда работа должна быть завершена. Следующая контрольная точка — убедиться, что работа выполнена. Мы видели, как компании пропускают этот шаг и полагаются на получение счета для подтверждения выполнения работы. Но иногда на получение счета могут уйти недели, намного дольше, чем терпение большинства жителей. Не подтверждая быстрое решение проблемы с обслуживанием, вы настраиваете себя на неудачи, отрицательные отзывы, головную боль и потерю дохода.
Мы видели, как компании пропускают этот шаг и полагаются на получение счета для подтверждения выполнения работы. Но иногда на получение счета могут уйти недели, намного дольше, чем терпение большинства жителей. Не подтверждая быстрое решение проблемы с обслуживанием, вы настраиваете себя на неудачи, отрицательные отзывы, головную боль и потерю дохода.
Последний важный этап проверки вполне очевиден: убедиться, что ваш резидент удовлетворен работой. Жильцы с плохим опытом обслуживания обычно не ждут вашего звонка, чтобы выразить свое разочарование. Либо они позвонят вам и превратят обычную работу в неотложную помощь, либо напишут вашей компании плохой отзыв. Связываясь с жильцами вскоре после завершения работы, вы можете опередить проблему и разочарование, тем самым предотвратив негативные отзывы.
Успех выглядит так
Процесс технического обслуживания с систематическими проверками и проверками — лучший способ убедиться, что жители довольны, а бизнес процветает. Но на начальном этапе бывает сложно оценить, приводит ли ваша система к успешным результатам. Признавая, что
каждогоопределение успеха может быть разным, тем не менее, мы обнаружили три показателя, которые особенно полезны для определения того, работает ваш процесс или нет.
Скорость ремонта
Удовлетворенность жителей
Стоимость
Существует прямая зависимость между тем, как быстро завершается ремонт, и тем, насколько житель удовлетворен работой. Но вы можете быть удивлены, узнав, как мало времени у вас действительно есть, чтобы решить эту проблему. Согласно нашему анализу, проблемы, на исправление которых уходит больше семи дней, имеют практически нулевой шанс получить положительный отзыв. Если проблема связана с системой HVAC, у вас еще меньше времени: обычно не более трех дней.В конце концов, измерение скорости ремонтных работ важно в той мере, в какой оно напрямую связано с удовлетворенностью жильцов, конечной мерой того, как работает ваш процесс обслуживания.
Было бы упущением, если бы мы не рассмотрели стоимость ремонтных работ.
Получение положительного отзыва после положительного отлично подходит для удержания жителей и привлечения новых, но от этого мало практического смысла, если вы тратите деньги на это.
Чтобы снизить затраты, важно установить прочные отношения с техническими специалистами / поставщиками.Такие отношения могут привести к тому, что ваша компания получит приоритет над другими, когда у технического специалиста есть несколько задач, которые нужно решить. Это также может привести к улучшению условий контракта и возможности согласования цен. Работа с качественным поставщиком, заинтересованным в благополучии вашей компании, также может означать уклонение от крупного и дорогостоящего «аварийного» ремонта. Как? Качественный поставщик сможет выявить потенциальные проблемы и приближающиеся системные сбои до того, как они достигнут этой точки, и, обладая прочными отношениями, вы можете быть уверены, что он заботится о вашем бизнесе, а не только о своем.Как говорится, унция профилактики стоит фунта лечения.
Применение на практике
Спросите 10 управляющих недвижимостью, как выглядит успешный процесс обслуживания, и вы, вероятно, получите 11 ответов. Тем не менее, мы думаем, что нашли единственный ответ, который вам действительно нужен: программное обеспечение Meld. С помощью нашего программного обеспечения отслеживание и проверка контрольных точек для каждого технического обслуживания может быть автоматизировано, и технический специалист, занимающийся проблемой, может сообщать о них в режиме реального времени. Это означает, что вы можете легко проверить работу, чтобы увидеть подробности того, где она находится в вашем процессе, а технические специалисты могут сообщать о статусе по мере прохождения каждого шага, избавляя вас от необходимости проверять все самостоятельно.
Мы понимаем, что перемены могут быть пугающими. Но с помощью эффективной системы решения проблем технического обслуживания вы в конечном итоге сэкономите время, деньги и стресс.
А с автоматизацией и проверенной системой, предлагаемой Meld software, изменить ваш процесс стало проще, чем когда-либо. Оставьте плохие отзывы и грязное обслуживание в прошлом, оптимизируя свой процесс и пожините награду в виде счастливых жителей, более счастливых инвесторов и беззаботного обслуживания недвижимости.
Узнайте больше, получив бесплатную консультацию у одного из наших специалистов.
Надежный арест контрольной точки G1 у почкующихся дрожжей: зависимость от передачи сигналов о повреждении ДНК и репарации | Журнал клеточной науки
Хотя большинство эукариот могут задерживаться в G1 после ионизирующего излучения, существование или значение контрольной точки G1 в S. cerevisiae было поставлено под сомнение. Предыдущие исследования ответа G1 на химические мутагены, рентгеновское или УФ-облучение показывают, что задержка до репликации временна и может отражать сильную контрольную точку внутри S-фазы.Мы исследовали реакцию дрожжей на двухцепочечные разрывы в G1 с помощью γ-облучения. Облучение G1 вызывает очаги репарации на разбросах хромосом и сдвиг полосы Rad53, характерный для активации, что свидетельствует об активном ответе на повреждение ДНК. В соответствии с задержкой G1, прорастание почек, удвоение полюса веретена и репликация ДНК задерживаются дозозависимым образом. Чувствительность к феромонам спаривания увеличивается до 18 часов, когда клетки G1 смертельно подвергаются γ- или УФ-облучению. Поразительно, что задержка G1 является преобладающим ответом на непрерывное γ-облучение в дозе, которая не приводит к потере жизнеспособности, но задерживает деление клеток.Как и контрольная точка G2 / M, задержка G1 полностью зависит от групп эпистаза RAD9 и RAD24 , но не зависит от POL ϵ. Смертельно облученные мутанты rad9 быстро выходят из G1, но выполняют медленную S-фазу, тогда как мутанты rad17 и rad24 полностью блокируют дефицит. В отличие от γ-облучения, остановка G1 после УФ-излучения зависит от RAD14 и , что позволяет предположить, что для активации контрольной точки требуется обработка повреждений ДНК.Следовательно, как и в ответе на контрольную точку G2 / M дрожжей, свободные концы ДНК и / или одноцепочечная ДНК необходимы и достаточны для того, чтобы вызвать остановку добросовестной контрольной точки G1.
В отличие от γ-облучения, остановка G1 после УФ-излучения зависит от RAD14 и , что позволяет предположить, что для активации контрольной точки требуется обработка повреждений ДНК.Следовательно, как и в ответе на контрольную точку G2 / M дрожжей, свободные концы ДНК и / или одноцепочечная ДНК необходимы и достаточны для того, чтобы вызвать остановку добросовестной контрольной точки G1.
Эукариотические клетки регулируют решение о фиксации в каждом новом клеточном цикле в середине G1 (Donjerkovic and Scott, 2000; Planas-Silva and Weinberg, 1997). Этот переход, называемый точкой рестрикции, или Старт (Levine et al., 1995; Toone et al., 1997), является основной мишенью факторов роста и передачи сигналов питания, и ему способствует активация циклин-зависимой киназы в G1-фазе. (CDK).Учитывая важность этого перехода, неудивительно, что многие клетки преимущественно арестовываются в G1 после повреждения ДНК (Bartkova et al., 1997) путем ингибирования активности CDK. Этот арест G1 позволяет произвести ремонт до того, как мутации могут быть дублированы в S-фазе или фрагментированные хромосомы будут разделены во время митоза.
Недавние данные предполагают, что повреждение ДНК обрабатывается эндонуклеазами для выявления одиночных цепей (Garvik et al., 1995; Lee et al., 1998; Lydall and Weinert, 1995). Эти нити затем обнаруживаются белками, участвующими как в репарации, так и в передаче сигналов, такими как супрессоры опухолей BRCA1 и Nibrin (Scully et al., 1997; Zhong et al., 1999). Считается, что комплексы этих и других факторов, которые образуются при индукции повреждения, маркируют места повреждения. Гомологи фосфоинозитол-3 киназы ATM и ATR, будучи однажды привлеченными к этим очагам, фосфорилируют и регулируют расположенные ниже эффекторы, включая киназу с двойной специфичностью CHK2 (Cortez et al., 1999; Мацуока и др. , 2000; Тиббетс и др., 2000). Последующее фосфорилирование нестабильного фактора транскрипции p53 способствует его накоплению (Chehab et al., 2000; Hirao et al., 2000), что приводит к экспрессии ингибитора CDK p21 CIP1 , предотвращая начало репликации (Li et al., 1994 ; Waldman et al., 1995). Клетки, лишенные ATM, p53 или p21, переходят в S-фазу без повреждения ДНК.
, 2000; Тиббетс и др., 2000). Последующее фосфорилирование нестабильного фактора транскрипции p53 способствует его накоплению (Chehab et al., 2000; Hirao et al., 2000), что приводит к экспрессии ингибитора CDK p21 CIP1 , предотвращая начало репликации (Li et al., 1994 ; Waldman et al., 1995). Клетки, лишенные ATM, p53 или p21, переходят в S-фазу без повреждения ДНК.
Соответствие между морфологией почек и развитием клеточного цикла у S.cerevisiae (Lew et al., 1997) превратил дрожжи в мощную систему для генетического анализа клеточного цикла (Nasmyth, 1996) и контрольных точек повреждения ДНК (Weinert, 1998b). Прохождение через Старт происходит до появления почек, когда клетки становятся необратимо преданными клеточному делению. Выход из G1 также проявляется активацией дрожжевого комплекса CDK C1b5,6-Cdc28, удвоением тела полюса веретена, началом синтеза ДНК и потерей чувствительности к феромону спаривания дрожжей, альфа-фактору (αf). Последующий рост почек продолжается через S-фазу и митоз.Возврат к G1 отмечен цитокинезом и отделением почек. Классические исследования остановки контрольных точек повреждения ДНК у S. cerevisiae показали, что облученные дрожжевые клетки накапливаются с крупнопочковатой морфологией (Weinert and Hartwell, 1988). Эта S-фаза или остановка G2 / M зависит от датчиков повреждения ДНК, которые активируют гомолог ATM MEC1 и гомолог CHK2 RAD53 (Longhese et al., 1998; Weinert, 1998a). Как и другие эукариоты, дрожжи обрабатывают повреждения ДНК, чтобы выявить отдельные цепи (Garvik et al., 1995), которые затем связываются белком RPA Rfa1p, чтобы инициировать сигнал повреждения ДНК (Pellicioli et al., 2001). Гомолог RFC RAD24 и PCNA-подобный комплекс, состоящий из MEC3, RAD17 и DDC1 (Kondo et al., 1999), могут распознавать эти поражения (Durocher and Jackson, 2001). Эта группа эпистаза RAD17 необходима для всех известных контрольных точек повреждения ДНК у почкующихся дрожжей. Повреждение ДНК в S-фазе активирует контрольную точку, зависящую от Polϵ POL2 , которая опосредует задержки в продвижении вилки и срабатывании источника. RAD9 , хотя и требуется для контрольной точки G2 / M, не работает в контрольной точке репликации ДНК. Путь RAD17 совместно с RAD9 или POLϵ (de la Torre-Ruiz et al., 1998; Navas et al., 1996) может рекрутировать Mec1p, способствуя его фосфорилированию Rad53p (Sanchez et al. , 1996).
Повреждение ДНК в S-фазе активирует контрольную точку, зависящую от Polϵ POL2 , которая опосредует задержки в продвижении вилки и срабатывании источника. RAD9 , хотя и требуется для контрольной точки G2 / M, не работает в контрольной точке репликации ДНК. Путь RAD17 совместно с RAD9 или POLϵ (de la Torre-Ruiz et al., 1998; Navas et al., 1996) может рекрутировать Mec1p, способствуя его фосфорилированию Rad53p (Sanchez et al. , 1996).
На пути к задержке образования крупной почки дрожжи выполняют зависимую от RAD17 и RAD9 задержку появления зачатков и репликации ДНК после повреждения ДНК, вызванного рентгеновскими лучами, УФ-излучением и MMS (de la Torre-Ruiz и другие., 1998; Siede et al., 1994; Siede et al., 1993). Стехиометрические ингибиторы Cdc28 существуют в дрожжах; однако не существует гомологов последовательностей р53 или р21. Вместо этого MEC1 -зависимая активация Rad53p в G1 (Pellicioli et al., 1999) задерживает экспрессию циклинов G1, замедляя активацию Cdc28p (Sidorova and Breeden, 1997). Тем не менее, существование истинного ареста G1 в ответ на повреждение ДНК недавно стало предметом сомнения (Neecke et al., 1999). Neecke с коллегами наблюдали, что УФ-облучение в G1 вызывает длительную остановку у мутантов, лишенных гена эксцизионной репарации RAD14 .Однако, хотя эти клетки rad14Δ поддерживают содержание ДНК 1N, имитируя арест G1, они вступают в S-фазу при наличии повреждения ДНК, что демонстрируется активацией ранних источников. Этот останов является независимым от RAD9 , что соответствует задержке S-фазы. Продвижение в клеточный цикл перед лицом неисправленных повреждений ДНК ставит под сомнение значимость или существование даже ранее описанной временной задержки контрольной точки G1 у почкующихся дрожжей.
Используя ионизирующее излучение, мы подтвердили, что повреждение ДНК в G1 задерживает как прорастание почек, так и дупликацию тела полюса веретена и расширяет окно чувствительности до αf. Эта остановка G1 зависит от дозы и требует RAD9 , но не POLϵ . Этот арест не временный. Вызванный летальным γ- или УФ-облучением, блокировка контрольных точек G1, зависящая от RAD9 и RAD17 , может удерживаться более 18 часов. В свою очередь, при приемлемых уровнях γ-облучения гаплоидные дрожжи преимущественно задерживаются в G1 без потери жизнеспособности. Эта остановка G1 после γ-облучения продлевается дефектами репарации DSB (двухцепочечного разрыва). Удивительно, но мутанты rad14 и задерживаются в G1 после γ-облучения, но демонстрируют дефект контрольной точки G1 после УФ.Поскольку УФ-излучение непосредственно не вызывает разрывов, неспособность вырезать перекрестные связи может эффективно маскировать повреждение ДНК до тех пор, пока репликация через повреждение не создаст единственную цепь и не инициирует сигнал повреждения ДНК. Эта модель примиряет очевидные конфликты в предыдущих исследованиях реакции контрольной точки повреждения ДНК S. cerevisiae G1.
Эта остановка G1 зависит от дозы и требует RAD9 , но не POLϵ . Этот арест не временный. Вызванный летальным γ- или УФ-облучением, блокировка контрольных точек G1, зависящая от RAD9 и RAD17 , может удерживаться более 18 часов. В свою очередь, при приемлемых уровнях γ-облучения гаплоидные дрожжи преимущественно задерживаются в G1 без потери жизнеспособности. Эта остановка G1 после γ-облучения продлевается дефектами репарации DSB (двухцепочечного разрыва). Удивительно, но мутанты rad14 и задерживаются в G1 после γ-облучения, но демонстрируют дефект контрольной точки G1 после УФ.Поскольку УФ-излучение непосредственно не вызывает разрывов, неспособность вырезать перекрестные связи может эффективно маскировать повреждение ДНК до тех пор, пока репликация через повреждение не создаст единственную цепь и не инициирует сигнал повреждения ДНК. Эта модель примиряет очевидные конфликты в предыдущих исследованиях реакции контрольной точки повреждения ДНК S. cerevisiae G1.
Штаммы были сконструированы из W303-1A ( MATa ade2-1 can1-100 ura3-1 leu2-3,112 his3-11,15 trp1-1 ).Нокауты генов, введение меток 13Myc и усечение C-конца для polϵ-12 :: kan R (Navas et al., 1995) проводили с помощью модификации гена на основе ПЦР (Longtine et al., 1998). polϵ-12 :: kan R мутантов, идентифицированных с помощью ПЦР, подтверждены чувствительностью к гидроксимочевине. RAD17, RAD24 и RAD9 были разрушены с помощью pDL183, pDL225 (Lydall and Weinert, 1997) и pTWO39 (Siede et al., 1993) соответственно. Дрожжевую среду и проточную цитометрию выполняли, как описано ранее (Ahn et al., 1999). Нокодазол (USB) использовали в концентрации 5 мкг / мл из 1000-кратного запаса в ДМСО. Пептид спаривания дрожжей (αf, Research Genetics) использовали в концентрации 5 мкМ из 1000 × исходной смеси в ДМСО. В ходе этих исследований гамма-облучение обеспечивалось источником Co Gammacell 220 60 мощностью 1-2 Гр / сек. Непрерывное γ-облучение обеспечивалось источником Cs Gammacell 1000 137 мощностью 4 Гр / мин. УФ-облучение при 254 нм проводили с помощью Stratalinker (Stratagene). Методы распространения хромосом выполнялись, как описано (Gasior et al., 1998). Оценка удвоения тела полюса веретена (SPD) в штамме, экспрессирующем слияние генов SPC42-GFP (Schutz and Winey, 1998), производилась с помощью флуоресцентной микроскопии (100 ×, Zeiss Axioskop) фиксированных формальдегидом клеток с подсчетом образования пары смежных или хорошо разделенные пятна зеленой флуоресценции. Элутриированные клетки G1 получали, как описано (Сидорова, Бриден, 1997).
В ходе этих исследований гамма-облучение обеспечивалось источником Co Gammacell 220 60 мощностью 1-2 Гр / сек. Непрерывное γ-облучение обеспечивалось источником Cs Gammacell 1000 137 мощностью 4 Гр / мин. УФ-облучение при 254 нм проводили с помощью Stratalinker (Stratagene). Методы распространения хромосом выполнялись, как описано (Gasior et al., 1998). Оценка удвоения тела полюса веретена (SPD) в штамме, экспрессирующем слияние генов SPC42-GFP (Schutz and Winey, 1998), производилась с помощью флуоресцентной микроскопии (100 ×, Zeiss Axioskop) фиксированных формальдегидом клеток с подсчетом образования пары смежных или хорошо разделенные пятна зеленой флуоресценции. Элутриированные клетки G1 получали, как описано (Сидорова, Бриден, 1997).
Белок экстрагировали разрушением стеклянных шариков в PBS pH 7.4, 5% глицерина, 0,5% Nonidet P40, 1 мМ PMSF и коктейль ингибиторов протеазы (Boehringer). Для вестерн-анализа 50 мкг общего белка разделяли на 8% SDS-PAGE, переносили в нитроцеллюлозу (Osmonics), зондировали моноклональным эпитопным антителом против α-Myc (9E10, Babco) и вторичным антителом овцы к мыши, конъюгированным с пероксидазой хрена (Amersham ) и разработан с помощью Pierce SuperSignal с использованием Hyperfilm ECL (Amersham). Анализ p13 Suc1 — (CalBiochem) киназы гистона h2 проводили, как описано (Amon et al., 1992), используя 50 мкг белка / анализ.
5 мл насыщенной ночной культуры разводили до ~ 10 7 клеток / мл в 50 мл YPD с αf. Клетки инкубировали (~ 3 часа) при 30 ° C до> 95% появления проекций спаривания. Аликвоты по 10 мл переносили в культуральные пробирки, уравновешивали на льду и облучали 0, 100, 200 или 400 Гр в облучателе 60 Co. αf удаляли вакуумной фильтрацией с 100 мл воды. Клетки на фильтрах переносили в культуральные пробирки и ресуспендировали при 22 ° C YPD путем встряхивания. С 10-минутными интервалами аликвоты 0,5 мл объединяли с 0,5 мл улавливающей среды (15 мкг / мл нокодазола, 15 мкМ αf в YPD), инкубировали в течение 90 минут при 22 ° C, затем готовили для проточной цитометрии. 2D-ворота (SSC по сравнению с FL2-A) на основе αf-арестованных контролей использовали для определения процента клеток с содержанием 1N ДНК в тестируемых образцах. Из каждого образца было проанализировано 50 000 клеток.
Клетки на фильтрах переносили в культуральные пробирки и ресуспендировали при 22 ° C YPD путем встряхивания. С 10-минутными интервалами аликвоты 0,5 мл объединяли с 0,5 мл улавливающей среды (15 мкг / мл нокодазола, 15 мкМ αf в YPD), инкубировали в течение 90 минут при 22 ° C, затем готовили для проточной цитометрии. 2D-ворота (SSC по сравнению с FL2-A) на основе αf-арестованных контролей использовали для определения процента клеток с содержанием 1N ДНК в тестируемых образцах. Из каждого образца было проанализировано 50 000 клеток.
После высвобождения из αf дрожжи входят в S-фазу в течение 45 минут и завершают синтез ДНК через 90 минут, что контролируется увеличением содержания ДНК (рис.2А). Предыдущее воздействие γ-излучения приводит к дозозависимой задержке. Клетки, облученные дозой 200 Гр (летальность ~ 10%), начинают увеличивать содержание ДНК через 30 минут после необлученного контроля. После 1000 Гр (~ 70 DSB / гаплоидный геном, ~ 95% летальность) клетки остаются 1N в течение более 2 часов (рис. 2A).
Рис. 2.
G1 γ-излучение приводит к дозозависимой задержке репликации. Αf-арестованные клетки дикого типа (A), rad9Δ и rad17Δ (B) клетки были облучены и выпущены в среду при 30 °. С.Аликвоты по 0,5 мл фиксировали в указанные моменты времени для проточной цитометрии. Линии, проведенные на графиках, показывают позиции 1N и 2N. Идентичные результаты были получены с 0 клеток (данные не показаны).
Рис. 2.
G1 γ-излучение приводит к дозозависимой задержке репликации. Αf-арестованные клетки дикого типа (A), rad9Δ и rad17Δ (B) клетки облучали и высвобождали в среду при 30 ° C. ° C. Аликвоты по 0,5 мл фиксировали в указанные моменты времени для проточной цитометрии. Линии, проведенные на графиках, показывают позиции 1N и 2N. Идентичные результаты были получены с 0 клеток (данные не показаны).
Линии, проведенные на графиках, показывают позиции 1N и 2N. Идентичные результаты были получены с 0 клеток (данные не показаны).
Эти данные согласуются с регулируемой задержкой клеточного цикла перед репликацией. Альтернативная гипотеза состоит в том, что потеря жизнеспособности и / или повреждение самой ДНК могут препятствовать своевременной репликации. Тем не менее, как необлученные, так и облученные (1000 Гр; летальность> 99% для штаммов с дефицитом контрольных точек) rad17Δ (рис.2B), тройные мутанты rad24Δ, rad17Δ rad24Δ rad9Δ и мутанты meclΔ (не показаны) входят в S-фазу в течение 30 минут и продолжают репликацию с аналогичной кинетикой. Это указывает на то, что репликация возможна, но предотвращена активацией контрольной точки. Напротив, клетки, в которых отсутствует только RAD9 , остаются 1N в течение более 2 часов после облучения 1000 Гр (фиг. 1A). Поскольку rad9Δ ячеек, в отличие от rad17Δ или rad24Δ , подходят для контрольной точки внутри S-фазы (Navas et al., 1996), наблюдаемые задержки 1N не могут отличить арест G1 от остановленной репликации (Neecke et al., 1999).
В свете этого результата следует отметить, что, хотя повышенная доза γ-излучения задерживает развитие клеточного цикла на ранних стадиях клеточного цикла, это не коррелирует с быстрым прогрессированием через митоз. Если бы контрольные точки повреждения ДНК G1 / S позволили завершить репарацию ДНК, то можно было бы ожидать, что клетки не будут задерживать последующий митоз.Необлученные клетки достигают содержания 2N ДНК через 120 минут после высвобождения из αf (фиг. 2A). Возврат к содержанию ДНК 1N наблюдается через 150 минут, а большинство клеток имеют 1N через 180 минут. Митоз, определяемый в этом анализе как продолжительность времени, проведенного при 2N, длился 1 час в необлученных клетках. После 200 Гр, что задерживало репликацию на 30 минут, клетки оставались при 2N до 240 минут после высвобождения αf. В других экспериментах было обнаружено, что эта задержка 2N после 200 Гр сохраняется в течение по крайней мере 5 часов (данные не показаны).Аналогичным образом не наблюдалось возврата к содержанию ДНК 1N при более высоких дозах γ-облучения. Это снова может служить аргументом в пользу отсутствия регуляции контрольной точки повреждения ДНК G1 или адаптивного ответа на γ-облучение в G1.
После 200 Гр, что задерживало репликацию на 30 минут, клетки оставались при 2N до 240 минут после высвобождения αf. В других экспериментах было обнаружено, что эта задержка 2N после 200 Гр сохраняется в течение по крайней мере 5 часов (данные не показаны).Аналогичным образом не наблюдалось возврата к содержанию ДНК 1N при более высоких дозах γ-облучения. Это снова может служить аргументом в пользу отсутствия регуляции контрольной точки повреждения ДНК G1 или адаптивного ответа на γ-облучение в G1.
Хотя прогрессирование и завершение синтеза ДНК подлежат регулированию контрольных точек внутри S-фазы (Paulovich and Hartwell, 1995), остановка репликации не влияет на завершение других событий Start (e.грамм. лечение гидроксимочевиной). Мы исследовали образование зачатков и дупликацию тела полюса веретена (SPD) после облучения G1 в клетках, несущих флуоресцентно маркированные полюса веретена посредством экспрессии слияния гена SPC42-GFP (Schutz and Winey, 1998) (Fig. 3). В необлученных клетках синтез ДНК, по данным проточной цитометрии, завершается более чем на 50% к 20 минутам. Прорастание бутонов завершается примерно на 50% к 40 минутам, а SPD составляет примерно на 50% к 75 минутам. После 200 Гр 50% бутонизация достигается только через 60 минут, тогда как SPD завершается на 50% через ~ 120 минут после высвобождения.Эти задержки увеличиваются с увеличением дозы. После 400 Гр и 800 Гр 50% бутонизация достигается за 90 минут, тогда как SPD> 25% не достигается в течение 120 минут.
Рис. 3.
Дупликация тела полюса веретена и задержка появления зачатка после γ-облучения G1. Штаммы SPC42-GFP (Schutz and Winey, 1998) были задержаны в αf и высвобождены после облучения. Аликвоты клеток по 0,5 мл фиксировали в 3.7% формальдегида для оценки прорастания почек и SPD или фиксированный для проточной цитометрии (данные не показаны).
Рис. 3.
Дупликация тела полюса веретена и задержка появления зачатка после γ-облучения G1. Штаммы SPC42-GFP (Schutz and Winey, 1998) были задержаны в αf и высвобождены после облучения. Аликвоты клеток по 0,5 мл фиксировали в 3,7% формальдегиде для оценки прорастания почек и SPD или фиксировали для проточной цитометрии (данные не показаны).
Мы также проанализировали появление активной CDK в качестве независимого маркера прохождения через Start.Мы использовали штамм, экспрессирующий RAD53-13Myc , чтобы одновременно сообщить о передаче сигналов повреждения ДНК (рис. 4A, B). После высвобождения из αf киназная активность Cdc28 обнаруживается через 30 минут в необлученных клетках дикого типа, а Rad53-13Myc остается неизмененным (фиг. 4A). Однако 200 Гр задержали появление активности киназы Cdc28p до ~ 45 минут, к тому времени Rad53-13Myc вернулся к своей неизменной подвижности. 400 Гр индуцировало стойкий сдвиг активности киназы Rad53-13Myc, а активность киназы Cdc28 не проявлялась до 60 минут.Для двойного мутанта rad9Δ rad17Δ RAD53-13Myc 400 Гр не задерживало активность киназы Cdc28 и не сдвигало Rad53-13Myc (фиг. 4B).
Рис. 4.
Rad53-13Myc смещается при увеличении G1. Клетки RAD53-13Myc были арестованы с помощью αf и высвобождены после облучения. Образцы белка собирали для α-Myc westerns, и в указанные моменты времени измеряли активность связанной с p13 suc1 киназы гистона h2 (A, B).В те же моменты времени дополнительные аликвоты фиксировали для проточной цитометрии (C) или инкубировали в течение 90 минут в улавливающей среде (с и без αf) перед фиксацией (D). Небольшая задержка в прогрессировании rad9Δ, rad17Δ после облучения по сравнению с необлученным диким типом наблюдалась только на фоне RAD53-13Myc .
Рис. 4.
Rad53-13Myc смещается при увеличении G1. Клетки RAD53-13Myc были арестованы с помощью αf и высвобождены после облучения.Образцы белка собирали для α-Myc westerns, и в указанные моменты времени измеряли активность связанной с p13 suc1 киназы гистона h2 (A, B). В те же моменты времени дополнительные аликвоты фиксировали для проточной цитометрии (C) или инкубировали в течение 90 минут в улавливающей среде (с и без αf) перед фиксацией (D). Небольшая задержка в прогрессировании rad9Δ, rad17Δ после облучения по сравнению с необлученным диким типом наблюдалась только на фоне RAD53-13Myc .
Задержка почкования, дупликация SPB и активность Cdc28 — все указывает на арест G1, но они не являются положительными индикаторами. Напротив, дрожжевые клетки реагируют только на фактор спаривания в G1. После освобождения от αf клетки остаются чувствительными к повторной остановке с помощью αf менее 30 минут. После этого они проходят Старт и становятся устойчивыми к αf. Мы проверили, может ли повреждение ДНК в G1 расширить это окно чувствительности αf.За время курса на рис. 4A, B, дополнительные аликвоты фиксировали для проточной цитометрии. Облученные клетки, по-видимому, задерживают репликацию после высвобождения из αf (фиг. 4C). Чтобы определить, остались ли эти клетки в G1 или вошли в S-фазу, аликвоты инкубировали в течение 90 минут в αf и нокодазоле (фиг. 4D). Последующее добавление αf задерживало клетки G1 с содержанием ДНК 1N, тогда как нокодазол улавливал клетки, которые прошли Start (Siede et al., 1996). Необлученные клетки RAD53-13Myc больше не задерживаются αf через 30 минут и накапливаются с содержанием ДНК 2N.Через 30 минут после 200 Гр αf продолжает задерживать> 80% клеток. После 400 Гр ~ 60% клеток могут быть арестованы αf за 45 минут. Однако в двойном мутанте rad9Δrad17Δ RAD53-13Myc , облученном 400 Гр, клетки теряли устойчивость к αf на 45 минут. Тем не менее, все клетки были способны увеличивать содержание ДНК. При инкубации только с нокодазолом в момент времени 0 минут как облученные, так и необлученные клетки накапливаются при 2N за 90 минут (фиг. 4D, верхние гистограммы).
Мы использовали количественную версию этого анализа ловушки αf / нокодазола для изучения генетической регуляции остановки G1.Необлученные клетки дикого типа rad9Δ и rad17Δ быстро теряют чувствительность к αf, поскольку менее 50% клеток остаются в G1 через 20 минут после высвобождения (фиг. 5). Клетки дикого типа демонстрируют зависимую от дозы γ-излучения задержку выхода из G1 (рис. 5A), тогда как 50% мутантов rad9Δ (рис. 5B) и rad17Δ (рис. 5C) остаются в G1 через 20 минут. независимо от дозы. Мутанты, лишенные RAD52 , дефектны как в рекомбинационной репарации, так и в репарации DSB с присоединением концов (Hegde and Klein, 2000).Обработанные только 50 Гр мутанты rad52Δ поддерживают 50% -ную популяцию G1 на 18 минут дольше, чем необлученные клетки, что пропорционально задержке на 200 Гр в способных к репарации клетках дикого типа (фиг. 5D).
Рис. 5.
Генетические требования для остановки G1. αf-арестованные клетки высвобождались после увеличения доз γ-облучения. В указанные моменты времени добавляли улавливающую αf / нокодазол среду, и клетки инкубировали 90 минут перед фиксацией.(Для wt, рад9Δ и рад17Δ : □, 0 Гр; ⋄, 100 Гр; ○, 200 Гр;, 400 Гр. Для рад52Δ (□, 0 Гр; ⋄, 50 Гр; ○, 100 Гр; ▵, 200 Гр)). Для сравнения сплошная линия показывает процент 1N от начальной популяции, а штриховая линия отмечает 50% 1N. Двойные мутанты rad9Δ, rad17Δ были неотличимы от любого одиночного мутанта в этом анализе (данные не показаны).
Рис. 5.
Генетические требования для ареста G1. αf-арестованные клетки высвобождались после увеличения доз γ-облучения.В указанные моменты времени добавляли улавливающую αf / нокодазол среду, и клетки инкубировали 90 минут перед фиксацией. (Для wt, рад9Δ и рад17Δ : □, 0 Гр; ⋄, 100 Гр; ○, 200 Гр;, 400 Гр. Для рад52Δ (□, 0 Гр; ⋄, 50 Гр; ○, 100 Гр; ▵, 200 Гр)). Для сравнения сплошная линия показывает процент 1N от начальной популяции, а штриховая линия отмечает 50% 1N. Двойные мутанты rad9Δ, rad17Δ были неотличимы от любого одиночного мутанта в этом анализе (данные не показаны).
Предыдущие эксперименты устанавливают арест G1, но не могут исключить возможность того, что контрольные точки репликации играют роль в наблюдаемых задержках. POLϵ обнаруживает повреждение ДНК, с которым сталкивается репликационная вилка, и требуется для контрольной точки внутри S-фазы (Navas et al., 1995). Анализ ловушки αf / нокодазола демонстрирует, что дефектные по контрольной точке polϵ-12 :: kan R клетки, облученные 200 Гр, остаются чувствительными к αf через 50 минут после высвобождения, тогда как необлученные контрольные и облученные или необлученные рад9Δpolϵ-12 :: kan Двойные мутанты R становятся устойчивыми к αf через 20 минут (рис.6).
Рис. 6.
POLϵ не требуется для КПП G1. Указанные штаммы обрабатывались, как показано на рис. 5.
Рис. 6.
POLϵ не требуется для контрольной точки G1. Указанные штаммы обрабатывали, как показано на рис. 5.
Предыдущие результаты использовали дозы гамма-излучения, которые индуцируют 10-100 DSB на гаплоидный геном дрожжей за 2-20 минут, вызывая 10-95% летальности (Frankenberg-Schwager and Frankenberg, 1990).При таких высоких дозах реакции контрольных точек могут осложняться реакцией на стресс и выживаемость. Чтобы устранить эти эффекты и оценить регуляцию контрольных точек при переносимой дозе облучения, мы инкубировали клетки в богатой среде при 22 ° C в облучателе 137 Cs, который индуцирует ~ 0,25 DSB / мин. Клетки дикого типа в логарифмической фазе, облученные в течение 4 часов, задерживают деление клеток, но остаются жизнеспособными, как измерено по эффективности посева (фиг. 7A, B). rad9Δrad17Δ двойные мутанты обнаруживают лишь незначительную задержку роста и быстро теряют жизнеспособность.Проточная цитометрия облученных клеток дикого типа показала, что популяция 1N клеток неуклонно увеличивается в течение 1 часа (фиг. 7C). В свою очередь, доля клеток, прошедших Start и показывающих бутоны малого и среднего размера, уменьшается с 33% до 12% в течение 30 минут. В облученных клетках rad9Δ rad17Δ сдвига G1 не наблюдается.
Рис. 7.
Задержка G1 является преобладающей реакцией на допустимое γ-излучение.Клетки с логарифмической фазой инкубировали в течение 3 часов при 450 рад / мин. С 60-минутными интервалами клетки собирали для определения эффективности посева (A), измерения OD 600 (B) или фиксировали для проточной цитометрии (C). В (A) 3 мкл 10-кратно серийно разведенных клеток наносили на планшеты YPD и инкубировали 48 часов при 30 ° C.
Рис. 7.
Задержка G1 является преобладающей реакцией на допустимое γ-излучение. Клетки с логарифмической фазой инкубировали в течение 3 часов при 450 рад / мин. С 60-минутными интервалами клетки собирали для определения эффективности посева (A), измерения OD 600 (B) или фиксировали для проточной цитометрии (C).В (A) 3 мкл 10-кратно серийно разведенных клеток наносили на планшеты YPD и инкубировали 48 часов при 30 ° C.
Чтобы проверить, поддерживает ли это переносимое излучение G1, арестованные клетки αf высвобождали и инкубировали в облучателе 137 Cs в течение 90 минут. Без облучения клетки быстро входят в клеточный цикл и завершают репликацию через 60 минут (рис. 8А). Облученные клетки оставались без ссадин с содержанием 1N ДНК даже через 90 минут.Однако после извлечения из облучателя эти клетки начали репликацию без задержки (рис. 8B). Подтверждая арест G1, αf ограничивает 57% этих клеток от завершения S-фазы (фиг. 8C). Несмотря на задержку в G1, облученные клетки не теряют жизнеспособности (не показано). Этот арест G1 также наблюдался, когда синхронизированная популяция G1 была получена посредством отмучивания (не показано).
Рис. 8.
Переносимое γ-излучение поддерживает G1.αf-арестованные клетки выпускали в свежую среду. Клетки разделяли между контрольными образцами при 22 ° C (A) и облученными образцами (B) и (C). Затем отбирали 15-минутные временные точки для контроля проточной цитометрии. Через 90 минут после высвобождения облученные образцы удаляли из источника 137 Cs и инкубировали с (C) или без (B) αf, и временной ход повторяли.
Рис. 8.
Допустимое γ-излучение поддерживает G1. αf-арестованные клетки выпускали в свежую среду.Клетки разделяли между контрольными образцами при 22 ° C (A) и облученными образцами (B) и (C). Затем отбирали 15-минутные временные точки для контроля проточной цитометрии. Через 90 минут после высвобождения облученные образцы удаляли из источника 137 Cs и инкубировали с (C) или без (B) αf, и временной ход повторяли.
Эти данные также обеспечивают сравнение с результатами на рис. 2. 90 минут в источнике 137 Cs приводят к накопленному γ-излучению 450 Гр.InFig. 2А, было обнаружено, что клетки, получавшие аналогичную дозу, доставленную примерно за 7 минут, сохраняли содержание ДНК 1N на 60 минут дольше, чем необлученные контроли (панель 400 Гр). Напротив, клетки, удаленные из источника 137 Cs, без промедления увеличивали содержание ДНК, как если бы накопленные повреждения не сохранялись. Это свидетельствует о продолжающейся репарации в G1 во время обработки 137 Cs, хотя эти результаты не исключают возможность того, что меньше разрывов цепей происходит при обработке на низких уровнях.
Контрольные точки задержки и репликации G1 описываются как временные задержки перед постоянным арестом G2 / M. Асинхронные клетки дикого типа в жидкой среде, обработанные 3000 Гр, минимальной дозой для 0% жизнеспособности, высевали в низком разведении на YPD для мониторинга появления почек и деления отдельных клеток (фиг. 9A). Из 38 ± 5% ячеек без связки в 0 часов 23 ± 4% оставались незаполненными через 18 часов. В двойном мутанте rad9Δ rad17Δ количество необузданных клеток снизилось с 43 ± 4% до 9 ± 3% через 18 часов.Эта потеря отразилась на 48 ± 3% клеток, подвергшихся второму и третьему делению. Альтернативно, клетки сначала высевали, а затем подвергали УФ-облучению 100 Дж / м 2 , летальной дозе. Здесь популяция без оболочек в клетках дикого типа снизилась только с 45 ± 7% до 42 ± 2% через 18 часов (рис. 9B), тогда как популяция без оболочек в клетках rad9Δ rad17Δ упала с 44 ± 3% до 21 ± 7%. Даже через 18 часов клетки без ссадин были живы и оставались в G1 (Schrick et al., 1997). Более 30% клеток дикого типа из вышеупомянутых экспериментов сформировали спаривающиеся проекции через 3 года.5 часов инкубации в αf после γ (фиг. 10A) или УФ-облучения (фиг. 10B).
Рис. 9.
Арест G1 без повязки может длиться 18 часов после повреждения ДНК. Штаммы с лог-фазой облучали 3000 Гр, затем разбавляли до ~ 10 4 клеток / мл перед посевом на YPD (A) или высевали перед УФ-облучением при 100 Дж / м 2 (B). Количество клеток подсчитывали сразу (0 ч) и через 18 часов после облучения.(C) Клетки высевали и инкубировали 0 или 20 минут перед облучением 100 Дж / м 2 . (Столбики ошибок представляют стандартную погрешность трех экспериментов.)
Рис. 9.
Арест G1 без повязки может длиться в течение 18 часов после повреждения ДНК. Штаммы с лог-фазой облучали 3000 Гр, затем разбавляли до ~ 10 4 клеток / мл перед посевом на YPD (A) или высевали перед УФ-облучением при 100 Дж / м 2 (B). Количество клеток подсчитывали сразу (0 ч) и через 18 часов после облучения.(C) Клетки высевали и инкубировали 0 или 20 минут перед облучением 100 Дж / м 2 . (Планки погрешностей представляют стандартное отклонение трех экспериментов.)
Рис. 10.
Необузданные клетки остаются чувствительными к αf. Клетки дикого типа (см. Фиг. 9A, B) собирали через 18 часов после γ (A) или УФ (B) излучения и инкубировали в αf в течение 3,5 часов при 30 ° C. Клетки фиксировали, как для проточной цитометрии, и оценивали (X63, Zeiss Axioskop) для образования спаривающихся выступов (стрелка).Проекции спаривания не наблюдались после инкубации без αf.
Рис. 10.
Необузданные клетки остаются чувствительными к αf. Клетки дикого типа (см. Фиг. 9A, B) собирали через 18 часов после γ (A) или УФ (B) излучения и инкубировали в αf в течение 3,5 часов при 30 ° C. Клетки фиксировали, как для проточной цитометрии, и оценивали (X63, Zeiss Axioskop) для образования спаривающихся выступов (стрелка). Проекции спаривания не наблюдались после инкубации без αf.
Ультрафиолетовое излучениештамма, лишенного гена эксцизионной репарации RAD14 , привело к падению количества клеток без ссадин с 42 ± 4% до 25 ± 6% через 18 часов (рис.9Б). В отличие от rad9Δ rad17Δ , эти клетки накапливаются с большими почками, предполагая, что только контрольная точка G1 нарушена на фоне rad14Δ . Напротив, γ-облучение штамма rad14Δ приводило к остановке G1, неотличимой от дикого типа (фиг. 9A).
50 минут, необходимые для доставки 3000 Гр, по сравнению с <10 секундами для 100 Дж / м 2 , могут лежать в основе очевидного преимущества УФ-облучения в поддержании безуплотненной остановки.Когда клетки дикого типа инкубировали в течение 20 минут на планшетах перед УФ-обработкой (фиг. 9C), 53 ± 5% клеток оставались несвязанными сразу после облучения. Однако только 26 ± 5% остались без липкой пленки через 18 часов.
Хотя многие эукариоты задерживаются в G1 после повреждения ДНК, гаплоидные почкующиеся дрожжи выполняют RAD9 -зависимую задержку G2 / M. Общее объяснение состоит в том, что восстановление DSB в G1 бесполезно без гомологичных сестринских хромосом, необходимых для эффективного восстановления.Тем не менее, повреждение ДНК в гаплоидных дрожжах G1 (1) активирует Rad53 (Sidorova and Breeden, 1997), (2) процессируется (de la Torre-Ruiz and Lowndes, 2000) и (3) способствует временной задержке G1 (Siede et al. ., 1993). Это свидетельствует в пользу контрольной точки G1, даже если она просто находится на пути к остановке митоза. Тем не менее, недавний отчет (Neecke et al., 1999) поставил под сомнение даже существование остановки G1 у дрожжей, предположив, что задержка зависит от контрольной точки внутри S-фазы. Репликация может обеспечить субстрат для гомологичной рекомбинации при репарации DSB, но репликация также отделяет поврежденную ДНК от репарационной матрицы.Итак, при каких обстоятельствах ячейка может полагаться на задержку G1, а не на контрольные точки S-фазы или G2 / M? Мы повторно исследовали реакцию почкующихся дрожжей на γ- и УФ-облучение в G1. Мы устанавливаем добросовестную контрольную точку повреждения ДНК G1 в гаплоидных дрожжевых клетках и предполагаем, что в некоторых обстоятельствах этот ответ более выражен, чем контрольные точки внутри S-фазы или G2 / M. Наши критерии для аутентичной контрольной точки повреждения ДНК G1 заключаются в том, что клетка должна обнаруживать повреждение до репликации и сигнализировать об остановке, которая препятствует прохождению клеткой Start.Чтобы быть физиологически значимым, продолжительность остановки должна быть дозозависимой и отражать способность клеток восстанавливать повреждения.
Рекрутирование Rfa1p в очаги повреждения и временная активация Rad53p демонстрируют, что гаплоидные дрожжи G1 обнаруживают разрывы цепи и сигнализируют об их присутствии. Затем мы использовали несколько критериев для определения фазы последующего ареста. Дублирование полюсов веретена, появление зачатков и активация Cdc28 задерживаются дозозависимым образом, что убедительно свидетельствует в пользу удлинения G1.Наконец, анализ ловушки αf / нокодазола количественно определил долю клеток G1 во время реакции на повреждение ДНК. Мы продемонстрировали, что клетки дикого типа остаются чувствительными к αf после γ-облучения, и что длительная чувствительность αf полностью зависит от передачи сигналов контрольной точки. RAD17, RAD24 или Мутанты MEC1 быстро становятся устойчивыми к αf независимо от дозы. В отличие от этой контрольной точки от задержки внутри S-фазы, мутация RAD9 полностью отменяет арест G1.В свою очередь, на арест G1 не влияет мутация POLϵ , которая аннулирует контрольную точку репликации.
Ключевой вопрос — есть ли связь между ремонтом и восстановлением с контрольной точки G1. Понятно, что задержка пропорциональна не только размеру ущерба, но и размеру ремонта. В гаплоидных клетках задержка G1 продлевается за счет мутации RAD52 или YKU70 , генов, участвующих в негомологичной репарации концевых соединений.Поразительно, что диплоидные дрожжи не задерживаются в G1 после 400 Гр, если у них нет генов рекомбинационной репарации RAD50 или RAD57 (J.N.F.G. and S.J.K., неопубликовано). Повышенная задержка репарации мутантов DSB предполагает, что арест G1 делает возможной значительную репарацию и предотвращает потенциально вредную S-фазу и митоз. Однако неясно, способна ли клетка G1 к полному восстановлению до прохождения Start, или даже клетки в G1 реагируют только на определенные типы повреждений.
После 200 Гр фосфорилированная форма Rad53p теряется по мере прохождения клетками Start. При 400 Гр Старт происходил даже в присутствии фосфорилированного Rad53p. Одна из интерпретаций состоит в том, что конкурирующие пути могут способствовать восстановлению и развитию клеточного цикла. Ячейки могут ждать завершения ремонта, но адаптируются и продолжают работу, если ремонт невозможен. Альтернативно, клетки G1 могут восстанавливать повреждения, которые могут быть вредными для репликации, но проходить Start, если оставшееся повреждение лучше подходит для репликационной репарации или гомологичной рекомбинационной репарации.Действительно, было обнаружено, что доза γ-облучения 200 Гр задерживает клетки в G1 на 15 минут, но эти же самые клетки прогрессируют до G2 / M и остаются с содержанием ДНК 2N в течение нескольких часов после того, как необлученные клетки делятся и возвращаются в G1. Это согласуется с неизлеченными поражениями, остающимися после контрольной точки G1.
Доказательства того, что задержка G1 действительно способствует своевременному восстановлению и, следовательно, защищает жизнеспособность, было обнаружено, когда клетки инкубировали в приемлемом источнике γ низкого уровня.В этих экспериментах клетки дикого типа накапливаются в G1 и способны выжить после 3-часового воздействия. Мутанты Checkpoint не могут арестоваться и быстро теряют жизнеспособность. Важно отметить, что клетки G1 дикого типа, высвобождаемые из источника 137 Cs, инициируют и завершают репликацию так же быстро, как необлученные клетки. Если бы продолжающаяся репарация не происходила в G1, можно было бы ожидать, что повреждения будут накапливаться, что приведет к низкой жизнеспособности и задержке репликации, как было обнаружено, когда аналогичные дозы были доставлены в источник 60 Co.Фактически, фаза S задерживалась только тогда, когда контрольная точка G1 была нарушена у мутантов rad9 Δ.
Продолжительность γ- и УФ-индуцированной остановки различается в фонах с дефицитом репарации. Ультрафиолетовое облучение явно могло вызвать остановку G1, но это было скомпрометировано в отсутствие RAD14 . Тем не менее, в ответ на γ-облучение, rad14 Δ штаммов задерживаются в G1, как и мутанты с репарацией ошибочного спаривания (не показаны).Это свидетельствует о том, что УФ-поражения, в отличие от DSB, вызванных γ-излучением, могут требовать метаболизма ДНК для обеспечения передачи сигналов контрольных точек. Вырезающая активность Rad14p может быть ограничивающим фактором для превращения димеров тимидина и другого УФ-повреждения одноцепочечных разрывов, которые активируют белки контрольных точек. В клетках, лишенных Rad14p, Polϵ-регулируемая остановка репликационной вилки обеспечивает альтернативный, Rad9p-независимый механизм контрольных точек. Это очень привлекательный ответ на парадоксальные результаты Neecke et al.(Neecke et al., 1999).
В заключение, наши результаты подтверждают подлинный арест контрольной точки G1 у почкующихся дрожжей, который зависит от количества повреждений ДНК и степени репарации. Эта остановка является физиологической, зависит от сигнальных путей контрольной точки и, по-видимому, является первичной реакцией на низкоуровневое переносимое γ-излучение и является конечной точкой остановки после летального УФ- или γ-излучения.
Благодарим сотрудников лаборатории Крон за технические советы и помощь, Дж.Choy для штамма Rad53-13Myc, T. Weinert для плазмид, M. Winey для штаммов SPC42-GFP , S. Gasior, J. Grushcow и D. Bishop за реагенты и помощь в распределении хромосом и J. Sidorova за совместное отмучивание методы. Мы благодарим С. Элледжа, Э. Фридберга, Дж. Хабера и Л. Хартвелла за полезные обсуждения. Эта работа была поддержана стипендией Фонда Джеймса С. Макдоннелла, грантом Фонда Эдварда Маллинкродта-младшего и NIH R01 GM60443.
Контроль клеточного цикла
Цели обучения
К концу этого раздела вы сможете:
- Понять, как клеточный цикл контролируется механизмами, как внутренними, так и внешними по отношению к клетке
- Объясните, как три контрольные точки внутреннего контроля возникают в конце G 1 , при переходе G 2 / M и во время метафазы
- Опишите молекулы, которые контролируют клеточный цикл посредством положительной и отрицательной регуляции.
Длина клеточного цикла сильно различается даже внутри клеток одного организма.У людей частота обновления клеток колеблется от нескольких часов на раннем этапе эмбрионального развития до в среднем от двух до пяти дней для эпителиальных клеток и до всей жизни человека, проведенной в G 0 специализированными клетками, такими как корковые нейроны. или клетки сердечной мышцы. Также существует вариация времени, которое клетка проводит в каждой фазе клеточного цикла. Когда быстро делящиеся клетки млекопитающих выращивают в культуре (вне тела при оптимальных условиях роста), продолжительность цикла составляет около 24 часов.В быстро делящихся человеческих клетках с 24-часовым клеточным циклом фаза G 1 длится примерно девять часов, фаза S длится 10 часов, фаза G 2 длится примерно четыре с половиной часа и фаза M длится примерно полчаса. У ранних зародышей плодовых мушек клеточный цикл завершается примерно за восемь минут. Время событий клеточного цикла контролируется механизмами, которые являются как внутренними, так и внешними по отношению к клетке.
Регуляция клеточного цикла внешними событиями
И инициация, и ингибирование клеточного деления запускаются внешними по отношению к клетке событиями, когда она собирается начать процесс репликации.Событие может быть таким простым, как смерть соседней клетки, или столь же масштабным, как выброс гормонов, способствующих росту, таких как гормон роста человека (HGH). Недостаток гормона роста может подавлять деление клеток, приводя к карликовости, тогда как избыток гормона роста может привести к гигантизму. Скученность клеток также может препятствовать делению клеток. Другой фактор, который может инициировать деление клетки, — это размер клетки; по мере роста клетки она становится неэффективной из-за уменьшения отношения поверхности к объему. Решение этой проблемы — разделить.
Независимо от источника сообщения, ячейка получает сигнал, и серия событий внутри ячейки позволяет ей перейти в промежуточную фазу. Двигаясь вперед от этой начальной точки, все параметры, требуемые во время каждой фазы клеточного цикла, должны быть соблюдены, иначе цикл не может продолжаться.
Постановление на внутренних контрольно-пропускных пунктах
Важно, чтобы продуцируемые дочерние клетки были точными дубликатами родительской клетки. Ошибки в дупликации или распределении хромосом приводят к мутациям, которые могут передаваться каждой новой клетке, полученной из аномальной клетки.Чтобы предотвратить дальнейшее деление скомпрометированной клетки, существуют механизмы внутреннего контроля, которые работают в трех основных контрольных точках клеточного цикла. Контрольная точка — это одна из нескольких точек в цикле эукариотической клетки, в которой переход клетки к следующей стадии цикла может быть остановлен до тех пор, пока условия не станут благоприятными. Эти контрольные точки возникают ближе к концу G 1 , на переходе G 2 / M и во время метафазы (рисунок 1).
Рисунок 1. Клеточный цикл контролируется на трех контрольных точках.Целостность ДНК оценивается на контрольно-пропускном пункте G1. Правильная дупликация хромосом оценивается на контрольной точке G2. Присоединение каждой кинетохоры к волокну веретена оценивается в контрольной точке M.
G
1 Контрольно-пропускной пунктКонтрольная точка G 1 определяет, все ли условия благоприятны для продолжения деления клеток. Контрольная точка G 1 , также называемая точкой ограничения (у дрожжей), представляет собой точку, в которой клетка необратимо присоединяется к процессу клеточного деления.Внешние воздействия, такие как факторы роста, играют большую роль в переносе клетки через контрольную точку G 1 . Помимо адекватных резервов и размера клеток, на контрольно-пропускном пункте G 1 проводится проверка на повреждение геномной ДНК. Ячейка, не отвечающая всем требованиям, не сможет перейти в фазу S. Ячейка может остановить цикл и попытаться исправить проблемное состояние, или ячейка может перейти в G 0 и ожидать дальнейших сигналов, когда условия улучшатся.
G
2 Контрольно-пропускной пунктКонтрольная точка G 2 блокирует вход в митотическую фазу, если не выполняются определенные условия. На контрольно-пропускном пункте G 1 производится оценка размера клеток и запасов белка. Однако наиболее важная роль контрольной точки G 2 — гарантировать, что все хромосомы реплицированы и реплицируемая ДНК не повреждена. Если механизмы контрольной точки обнаруживают проблемы с ДНК, клеточный цикл останавливается, и клетка пытается либо завершить репликацию ДНК, либо восстановить поврежденную ДНК.
Контрольно-пропускной пункт M
Контрольная точка M возникает ближе к концу метафазной стадии кариокинеза. Контрольная точка M также известна как контрольная точка веретена, потому что она определяет, все ли сестринские хроматиды правильно прикреплены к микротрубочкам веретена. Поскольку разделение сестринских хроматид во время анафазы является необратимым этапом, цикл не будет продолжаться до тех пор, пока кинетохоры каждой пары сестринских хроматид не будут прочно закреплены по крайней мере на двух веретенообразных волокнах, выходящих из противоположных полюсов клетки.
Ссылка на обучение
Посмотрите, что происходит на контрольных точках G 1 , G 2 и M, посетив этот веб-сайт, чтобы увидеть анимацию клеточного цикла.
Регулятор молекул клеточного цикла
В дополнение к внутренне контролируемым контрольным точкам существуют две группы внутриклеточных молекул, которые регулируют клеточный цикл. Эти регуляторные молекулы либо способствуют переходу клетки к следующей фазе (положительная регуляция), либо останавливают цикл (отрицательная регуляция).Молекулы-регуляторы могут действовать индивидуально или влиять на активность или продукцию других регуляторных белков. Следовательно, отказ одного регулятора может почти не повлиять на клеточный цикл, особенно если одно и то же событие контролируется несколькими механизмами. И наоборот, действие недостаточного или нефункционирующего регулятора может быть широкомасштабным и, возможно, фатальным для клетки, если затронуты несколько процессов.
Положительная регуляция клеточного цикла
Две группы белков, называемые циклинами и циклинзависимыми киназами (Cdks), отвечают за прохождение клетки через различные контрольные точки.Уровни четырех циклиновых белков колеблются на протяжении клеточного цикла предсказуемым образом (рис. 2). Повышение концентрации циклиновых белков вызывается как внешними, так и внутренними сигналами. После того, как клетка переходит на следующую стадию клеточного цикла, циклины, которые были активны на предыдущей стадии, разлагаются.
Рис. 2. Концентрации циклиновых белков изменяются на протяжении клеточного цикла. Существует прямая корреляция между накоплением циклина и тремя основными контрольными точками клеточного цикла.Также обратите внимание на резкое снижение уровней циклина после каждой контрольной точки (переход между фазами клеточного цикла), поскольку циклин разрушается цитоплазматическими ферментами. (кредит: модификация работы «WikiMiMa» / Wikimedia Commons)
Рис. 3. Циклинзависимые киназы (Cdks) — это протеинкиназы, которые при полной активации могут фосфорилировать и, таким образом, активировать другие белки, которые продвигают клеточный цикл мимо контрольной точки. Чтобы стать полностью активированным, Cdk должен связываться с белком циклина, а затем фосфорилироваться другой киназой.
Циклины регулируют клеточный цикл только тогда, когда они прочно связаны с Cdks. Чтобы быть полностью активным, комплекс Cdk / cyclin также должен фосфорилироваться в определенных местах. Как и все киназы, Cdks представляют собой ферменты (киназы), которые фосфорилируют другие белки. Фосфорилирование активирует белок, изменяя его форму. Белки, фосфорилированные Cdks, участвуют в продвижении клетки к следующей фазе. (Рисунок 3). Уровни белков Cdk относительно стабильны на протяжении клеточного цикла; однако концентрации циклина колеблются и определяют, когда образуются комплексы Cdk / циклин.Различные циклины и Cdks связываются в определенных точках клеточного цикла и, таким образом, регулируют разные контрольные точки.
Поскольку циклические колебания уровней циклина основаны на времени клеточного цикла, а не на конкретных событиях, регуляция клеточного цикла обычно происходит либо с помощью одних молекул Cdk, либо комплексов Cdk / циклин. Без определенной концентрации полностью активированных комплексов циклин / Cdk клеточный цикл не может проходить через контрольные точки.
Хотя циклины являются основными регуляторными молекулами, которые определяют поступательный импульс клеточного цикла, существует несколько других механизмов, которые регулируют ход цикла с отрицательными, а не положительными эффектами.Эти механизмы по существу блокируют развитие клеточного цикла до тех пор, пока не будут устранены проблемные условия. Молекулы, препятствующие полной активации Cdk, называются ингибиторами Cdk. Многие из этих молекул-ингибиторов прямо или косвенно контролируют конкретное событие клеточного цикла. Блок, помещенный на Cdks молекулами ингибитора, не будет удален до тех пор, пока не будет выполнено определенное событие, которое отслеживает ингибитор.
Отрицательная регуляция клеточного цикла
Вторая группа регуляторных молекул клеточного цикла — негативные регуляторы.Отрицательные регуляторы останавливают клеточный цикл. Помните, что при положительном регулировании активные молекулы заставляют цикл прогрессировать.
Наиболее изученными негативными регуляторными молекулами являются белок ретинобластомы (Rb), p53 и p21. Белки ретинобластомы представляют собой группу белков-супрессоров опухолей, распространенных во многих клетках. Обозначения 53 и 21 относятся к функциональным молекулярным массам белков (p) в килодальтонах. Многое из того, что известно о регуляции клеточного цикла, получено в результате исследований, проведенных с клетками, утратившими регуляторный контроль.Было обнаружено, что все три этих регуляторных белка повреждены или нефункциональны в клетках, которые начали бесконтрольно реплицироваться (стали злокачественными). В каждом случае основной причиной неконтролируемого прохождения клеточного цикла была неправильная копия регуляторного белка.
Rb, p53 и p21 действуют в основном на контрольной точке G 1 . p53 — это многофункциональный белок, который оказывает большое влияние на приверженность клетки к делению, потому что он действует, когда есть поврежденная ДНК в клетках, которые подвергаются подготовительным процессам во время G 1 .Если обнаружена поврежденная ДНК, p53 останавливает клеточный цикл и привлекает ферменты для восстановления ДНК. Если ДНК не может быть восстановлена, p53 может вызвать апоптоз или самоубийство клетки, чтобы предотвратить дублирование поврежденных хромосом. По мере повышения уровня p53 запускается производство p21. p21 обеспечивает остановку цикла, диктуемого p53, путем связывания и ингибирования активности комплексов Cdk / циклин. По мере того, как клетка подвергается большему стрессу, накапливаются более высокие уровни p53 и p21, что снижает вероятность перехода клетки в S-фазу.
Rb оказывает свое регулирующее влияние на другие положительные белки-регуляторы. В основном Rb контролирует размер ячейки. В активном дефосфорилированном состоянии Rb связывается с белками, называемыми факторами транскрипции, чаще всего с E2F (рис. 4). Факторы транскрипции «включают» определенные гены, позволяя производить белки, кодируемые этим геном. Когда Rb связан с E2F, производство белков, необходимых для перехода G 1 / S, блокируется. По мере увеличения размера клетки Rb медленно фосфорилируется, пока не станет инактивированным.Rb высвобождает E2F, который теперь может включать ген, продуцирующий переходный белок, и этот конкретный блок снимается. Чтобы ячейка прошла через каждую из контрольных точек, все положительные регуляторы должны быть «включены», а все отрицательные регуляторы должны быть «выключены».
Рис. 4. Rb останавливает клеточный цикл и освобождает его в ответ на рост клеток.
Rb и другие белки, негативно регулирующие клеточный цикл, иногда называют супрессорами опухолей. Как вы думаете, почему для этих белков подходит название «опухолевый супрессор»?
Сводка раздела
Каждый этап клеточного цикла контролируется внутренними средствами контроля, называемыми контрольными точками.В клеточном цикле есть три основных контрольных точки: одна ближе к концу G 1 , вторая на переходе G 2 / M и третья во время метафазы. Положительные молекулы регулятора позволяют клеточному циклу перейти к следующей стадии. Отрицательные молекулы регулятора контролируют клеточные условия и могут останавливать цикл до тех пор, пока не будут выполнены определенные требования.
Дополнительные вопросы для самопроверки
1. Rb и другие белки, негативно регулирующие клеточный цикл, иногда называют супрессорами опухолей.Как вы думаете, почему для этих белков подходит название «опухолевый супрессор»?
2. Опишите общие условия, которые должны выполняться на каждой из трех основных контрольных точек клеточного цикла.
3. Объясните роль положительных регуляторов клеточного цикла по сравнению с отрицательными регуляторами.
4. Какие шаги необходимо выполнить, чтобы Cdk стал полностью активным?
5. Rb — отрицательный регулятор, который блокирует клеточный цикл в контрольной точке G 1 , пока клетка не достигнет необходимого размера.Какой молекулярный механизм использует Rb для остановки клеточного цикла?
ответы
1. Rb и другие негативные регуляторные белки контролируют деление клеток и, следовательно, предотвращают образование опухолей. Мутации, мешающие этим белкам выполнять свои функции, могут привести к раку.
2. Контрольная точка G 1 отслеживает адекватный рост клеток, состояние геномной ДНК, адекватные запасы энергии и материалы для S-фазы. В контрольной точке G 2 ДНК проверяется, чтобы убедиться, что все хромосомы были продублированы и что нет ошибок во вновь синтезированной ДНК.Дополнительно оцениваются размер клеток и запасы энергии. Контрольная точка M подтверждает правильное прикрепление волокон митотического веретена к кинетохорам.
3. Положительные клеточные регуляторы, такие как циклин и Cdk, выполняют задачи, которые продвигают клеточный цикл к следующей стадии. Отрицательные регуляторы, такие как Rb, p53 и p21, блокируют развитие клеточного цикла до тех пор, пока не произойдут определенные события.
4. Cdk должен связываться с циклином, и он должен фосфорилироваться в правильном положении, чтобы стать полностью активным.
5. Rb активен, когда он дефосфорилирован. В этом состоянии Rb связывается с E2F, который является фактором транскрипции, необходимым для транскрипции и возможной трансляции молекул, необходимых для перехода G 1 / S. E2F не может транскрибировать определенные гены, когда он связан с Rb. По мере увеличения размера клетки Rb фосфорилируется, инактивируется и высвобождает E2F. Затем E2F может способствовать транскрипции генов, которые он контролирует, и будут продуцироваться переходные белки.
Глоссарий
Контрольная точка клеточного цикла: механизм , который контролирует готовность эукариотической клетки к продвижению через различные стадии клеточного цикла
циклин: один из группы белков, которые действуют вместе с циклин-зависимыми киназами, помогая регулировать клеточный цикл путем фосфорилирования ключевых белков; концентрации циклинов колеблются на протяжении клеточного цикла
циклин-зависимая киназа: одна из группы протеинкиназ, которая помогает регулировать клеточный цикл при связывании с циклином; он функционирует, чтобы фосфорилировать другие белки, которые либо активируются, либо инактивируются фосфорилированием
p21: регуляторный белок клеточного цикла, который ингибирует клеточный цикл; его уровни контролируются p53
p53: регуляторный белок клеточного цикла, который регулирует рост клеток и контролирует повреждение ДНК; он останавливает развитие клеточного цикла в случае повреждения ДНК и может вызвать апоптоз
белок ретинобластомы (Rb): регуляторная молекула, которая оказывает негативное влияние на клеточный цикл, взаимодействуя с фактором транскрипции (E2F)
Выкройка сувенира
Намерение
- Не нарушая инкапсуляцию, захватите и экстернализируйте внутреннее состояние объекта, чтобы объект мог быть возвращен в это состояние позже.
- Волшебный файл cookie, который инкапсулирует возможность «контрольной точки».
- Повысить отмену или откат до полного состояния объекта.
Проблема
Требуется восстановить объект в его предыдущее состояние (например, «отменить» или операции «откат»).
Обсуждение
Клиент запрашивает Memento у исходного объекта, когда ему необходимо контрольная точка состояния исходного объекта. Исходный объект инициализирует Memento с характеристикой его состояния.Клиент — это «хранитель» Memento, но только исходный объект может хранить и извлекать информацию из Memento (Memento «непрозрачен» для клиент и все остальные объекты). Если клиенту впоследствии потребуется «откатить» состояние исходного объекта, он возвращает Memento обратно в исходный объект для восстановления.
Возможность неограниченного «отмены» и «повтора» может быть легко реализована. со стопкой объектов Command и стопкой объектов Memento.
Шаблон проектирования Memento определяет три различные роли:
- Оригинатор — объект, умеющий спасти себя.
- Смотритель — объект, который знает, почему и когда Создателю необходимо сохранить и восстановить себя.
- Memento — сейф, который записывается и читается Создателем и находится под присмотром Смотрителя.
Структура
Пример
Memento фиксирует и экстернализирует внутреннее состояние объекта, чтобы что впоследствии объект может быть восстановлен до этого состояния. Этот образец обычное дело среди механиков-самоделок, ремонтирующих барабанные тормоза на своих легковые автомобили.Барабаны снимаются с двух сторон, обнажая оба правых и левые тормоза. Только одна сторона разбирается, а другая служит Напоминание о том, как детали тормоза сочетаются друг с другом. Только после того, как работа с одной стороны закончено, с другой стороны в разобранном виде. Когда вторая сторона разобрана, первая сторона действует как сувенир.
Контрольный список
- Определите роли «смотрителя» и «создателя».
- Создайте класс Memento и объявите создателя своим другом.
- Смотритель знает, когда «проверять» отправителя.
- Originator создает Memento и копирует его состояние в этот Memento.
- Смотритель держится (но не может заглянуть в него).
- Смотритель знает, когда «откатить» отправителя.
- Originator восстанавливается, используя сохраненное состояние в Memento.
Эмпирические правила
- Command и Memento действуют как магические жетоны, которые нужно передавать и вызывать позже.В Command токен представляет собой запрос; в Memento, он представляет внутреннее состояние объекта в конкретном время. Полиморфизм важен для Command, но не для Memento, потому что его интерфейс настолько узок, что сувенир можно передать только как значение. Команда
- может использовать Memento для поддержания состояния, необходимого для отмены операция.
- Memento часто используется вместе с Iterator. Итератор может использовать Memento для фиксации состояния итерации. Итератор хранит Memento внутренне.
Поддержите наш бесплатный веб-сайт и приобретите электронную книгу!
- Подробное объяснение 22 шаблонов проектирования и 8 принципов
- 406 хорошо структурированные, легко читаемые страницы без жаргона
- 228 понятных и полезных иллюстраций и диаграмм
- Архив с примерами кода на 4 языках
- Поддерживаются все устройства: форматы EPUB / MOBI / PDF


