Какую кислоту заливают в аккумулятор автомобиля: серную, соляную или другую?
Какую кислоту заливают в аккумулятор
В некоторых видах автомобильных АКБ в качестве электролита может использоваться щелочь. К примеру, никель-кадмиевый тип АКБ. Помимо этого, есть группа гелевых аккумуляторов, где жидкость находится в связанном состоянии. Но, по сути, это раствор серной кислоты, переведенный в гелеобразное состояние или им пропитанное стекловолокно.
Серная кислота широко используется при производстве свинцово-кислотных АКБ для транспортных средств. Ее концентрация в электролите около 30-35%, остальное – дистиллированная вода. Применять обычную водопроводную воду запрещено, поскольку в ее состав входят соли многих металлов и их попадание в АКБ сократит срок его службы.
Как правило, в бытовой сфере серной кислоты с 30%процентов вполне достаточно, однако в сфере производства довольно часто используется кислота с более высокой концентрацией. Получить концентрированную серную кислоту можно в две стадии.
Применение серной кислоты и ее сорта
Существует несколько сортов серной кислоты, к ним относятся:
- Нитрозная или башенная. Концентрация составляет 75%, а плотность этого сорта находится в пределах 1,67 г/см3. Такое название он получил благодаря методу производства нитрозным способом в футерованных башнях. Обжиговый газ обрабатывается нитрозой и в процессе реакции получается кислота и оксиды азота.
- Контактная. Концентрация достигает 92,5-98%, плотность – 1,837 г/см3 . Данный сорт также получается из обжигового газа с содержанием двуокиси SO2. В процессе химической реакции происходит ее окисление при контакте с катализатором из ванадия.
- Аккумуляторная. Концентрация 92-94%, плотность – 1,835 г/см 3.

- Сорт Олеум. Концентрация довольна высокая –104,5%, плотность – 1,897 г/см 3 , представляет собой концентрированный раствор из кислоты и SO3.
- Высокопроцентный олеум. Концентрация достаточно высокая –114,6%, плотность – 2,002 г/см3.
Процессы, происходящие в АКБ с участием электролита
Функционирование свинцово-кислотного АКБ основывается на химических процессах, протекающих с помощью электролита. АКБ автомобиля из пластин: положительных и отрицательных, погруженных в раствор кислоты. Пластины имеют токоотводящие решетки, выполненные из свинца с добавками (зависит от типа АКБ), а на решетках отрицательных электродов нанесен сероватый порошок свинца, на положительных – красновато-коричневый диоксид свинца.
Показатель плотности электролита на заряженном АКБ находится в диапазоне 1,128─1,300 г/см3. При разрядке АКБ в результате химической реакции из электролита стремительно расходуется кислота и плотность значительно падает.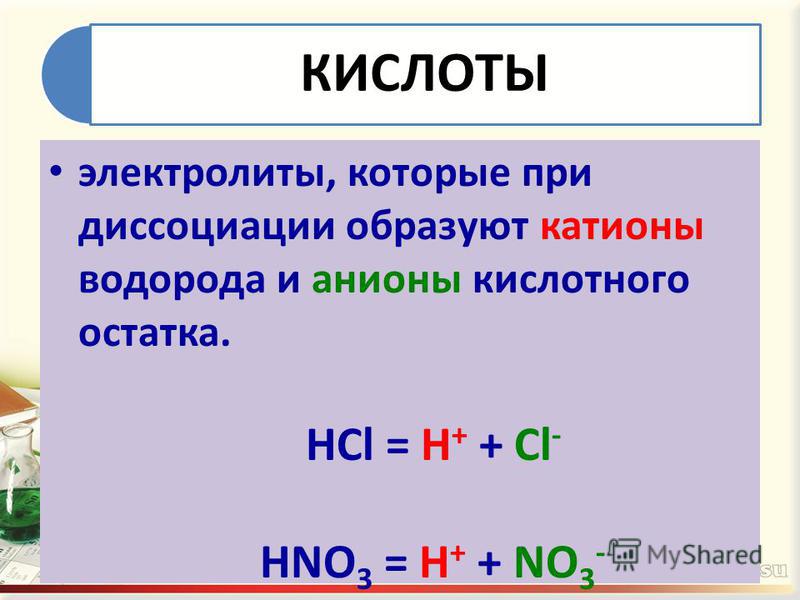
Полностью заряженный элемент аккумулятора транспортного средства выдает напряжение в пределах 2,5-2,7 В без нагрузки на выводах. В случае нагрузки данное напряжение несколько проседает до 2,1 В буквально за несколько минут. За этот короткий период на поверхности отрицательных электродов успевает сформироваться плотный слой PbSO4. Соответственно, напряжение элемента на подключенной к авто АКБ составляет 2,15 В.
Если разряжать АКБ транспортного средства небольшим током (примерно 10% от номинальной емкости), тогда через 1-2 ч разрядки напряжение элемента снизится до 2 В. Это обусловлено тем, что в этом момент формируется большое количество PbSO4, который, в свою очередь сильно забивает поры активной массы. Помимо этого, проявляется рост внутреннего сопротивления элементов аккумулятора и значительно снижается концентрация жидкости.
Контроль за состоянием электролита
Контроль за электролитом – важная процедура, которая должна проводиться регулярно. От владельца транспортного средства требуется контролировать как уровень электролита в АКБ, так и его плотность. Чтобы проверить уровень электролита рекомендуется использовать стеклянную трубочку, но если ее нет, то можно использовать прозрачный корпус от ручки. Для измерения нужно открыть пробки всех банок и погрузить пластиковую/стеклянную трубочку до пластин. После чего с верхнего конца ее плотно зажать пальцем и поднять.
Чтобы проверить уровень электролита рекомендуется использовать стеклянную трубочку, но если ее нет, то можно использовать прозрачный корпус от ручки. Для измерения нужно открыть пробки всех банок и погрузить пластиковую/стеклянную трубочку до пластин. После чего с верхнего конца ее плотно зажать пальцем и поднять.
Оптимальный уровень электролита в трубке должен быть 10-12 мм. В случае нехватки электролита доливается вода до требуемого уровня. Выше необходимого уровня воду заливать не следует.
Срок службы электролита
Стоит знать, что кислотный электролит – это раствор, который не имеет срока годности. Срок службы для такой жидкости определяется исключительно исходя из того, как она способна выполнять свои функции.
К показателям, которые влияют на срок использования АКБ, относятся:
- Плотность электролита.
- Температурный режим функционирования АКБ.
- Степень заряженности аккумулятора.
Если эти показатели соответствуют норме, срок службы электролита довольно продолжительный.
Как поднять плотность электролита
Повышение плотности жидкости происходит вследствие повышения температуры и в результате процесса, который называется гидролиз. Чтобы этот показатель находился на необходимом уровне, требуется регулярное добавление дистиллята. Если датчик концентрации кислоты в электролите показывает значение ниже, чем 1,275 г/см3, следует его поднимать.
Кислотность электролита можно поднять двумя способами: полной заменой старого электролита на новый или внесением разбавленной концентрированной кислоты.
В случае разбавления жидкости следует провести ряд действий для каждой банки:
- Постараться откачать максимальное количество электролита посредством шприца или резиновой груши.
- Внести в банку 0,5 его объема плотностью от 1,26 до 1,28 г/см3.
- Чтобы тщательно перемешать жидкость, необходимо на выводы подать нагрузку с минимальной мощностью.
При замере плотности стоит определить необходимый уровень. Если не произошло изменений, тогда в половину оставшегося объема требуется внести еще электролит.
Если не произошло изменений, тогда в половину оставшегося объема требуется внести еще электролит.
С помощью подобных манипуляций можно довести до оптимальной плотности концентрацию кислоты в электролите.
В случае, если показатель индикатора показывает значения плотности ниже, чем 1,2 г/см3, требуется полная замена электролита, так как способом доливки поднять ее не получится. Однако если батарее менее года, то стоит попробовать.
Важно! Серная кислота – агрессивная средой для кожных покровов человека и его одежды. Поэтому во время работ с открытой батареей рекомендуется позаботиться о мерах защиты: обязательно надеть резиновые перчатки, защитные очки. Так же пригодится прорезиненный фартук.
Порядок заливки и доливки кислотного электролита в АКБ
Составляющие компоненты электролита – кислоту и дистиллированную воду, нужно смешать в разных пропорциях. Так, если необходимо получить электролит с уровнем плотности 1,29 г/см³, то к 1 литру необходимо добавить 0,36 л кислоты, то есть в соотношении 1:3.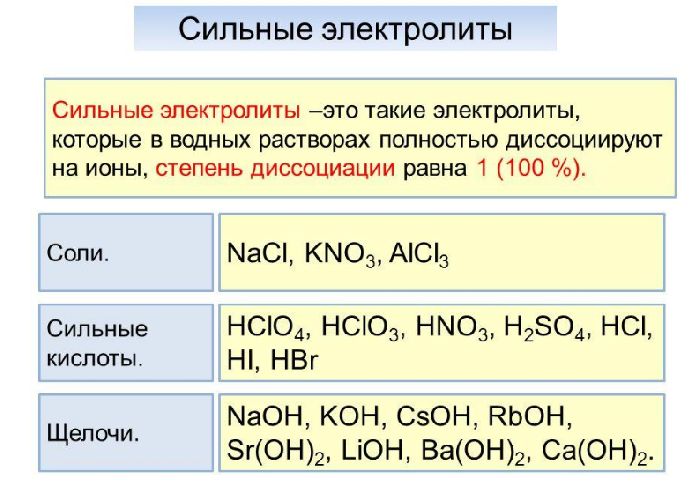
Заливку электролита производят стеклянной или полиэтиленовой трубочкой до уровня 10-15 мм над свинцовыми пластинами. После этого аккумулятор оставляют на два часа, однако в некоторых случаях плотность при этом падает. Далее АКБ заряжают током в десять раз меньшим его емкости в течение 4 часов.
Проверять плотность АКБ необходимо раз в 2-3 месяца. Для этого используется специальный прибор – ареометр.
Важно! В целях техники безопасности необходимо знать, что заливать нужно именно серную кислоту в дистилированную воду, но не наоборот, поскольку высока вероятность возникновения химической реакции данной смеси с выделением брызг и тепла.
Процесс приготовления электролита
Электролит для АКБ можно, конечно, приобрести в специализированных магазинах, но можно сделать его самостоятельно и при этом научиться регулировать плотность.
Для приготовления электролита потребуются следующие компоненты:
- Вода дистиллированная.
- Серная кислота.

- Емкость из материала, устойчивого к воздействию концентрированного химического вещества: стекла, керамики, свинца.
- Эбонитовая палочка (для размешивания жидкости).
Для приготовления в специальную емкость заливается вода, после – серная кислота. Компоненты тщательно палочкой смешиваются. Процедуру проводят последовательно, поскольку при обратном варианте есть вероятность получить ожоги.
Полученное вещество плотно накрывается и оставляется минимум на сутки до выпадения осадка и остывания. Стоит знать, что при обратном проведении заливки (сначала серная кислота, потом – вода), возможна гидратации и образование в кислоте тепла. Соответственно, вода может закипеть и спровоцировать разбрызгивание.
Срок службы АКБ ограничен ее техническими характеристиками. Однако при неправильном его использовании и хранении этот показатель может существенно снизиться. Чтобы АКБ не изнашивалась слишком стремительно, специалисты рекомендуют следить за плотностью электролита и его уровнем.
Концентрация и плотность серной кислоты. Зависимость плотности серной кислоты от концентрации в аккумуляторе автомобиля
Разбавленная и концентрированная серная кислота — это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H+-ионы в растворе.
H2SO4 = H+ + HSO4— ;
HSO4— = H + + SO4-2 .
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H+-ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H+-ион и оставляя сульфат-ион (SO4-2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель — в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Zn + Н2SO4 =ZnSO4 + H2.
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см3, может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2 O.
Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см3, 100 см3 и 1 дм3). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
Предположим, что мы имеем раствор Н2SO4в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
По ней определяем искомую величину, которая равна 1,4987 г/см3. Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.
ниже.
Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное — вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности.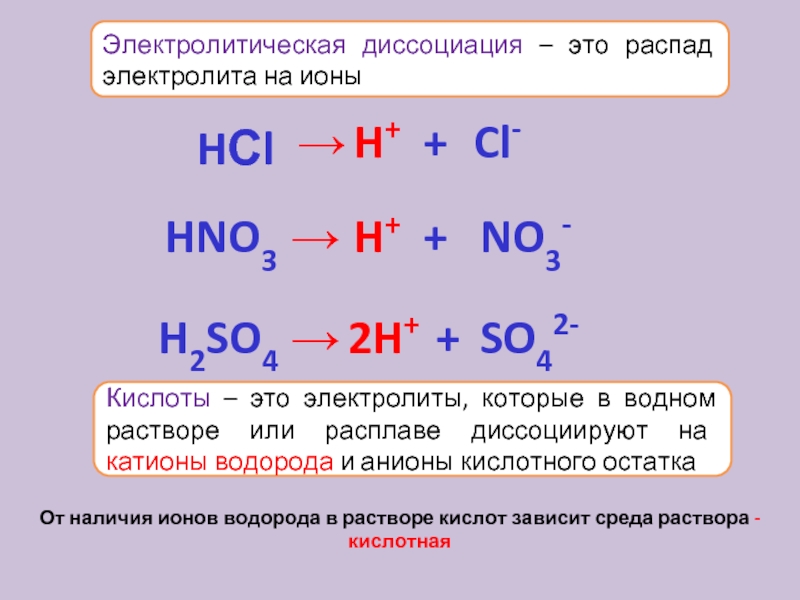 Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем — на втором этапе — поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем — на втором этапе — поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) — 75 %.
 Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл. - Контактная — 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м3. Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум — 104,5 %. Плотность его равна 1896,8 кг/м3. Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты — именно 104,5 %.

- Высокопроцентный олеум — 114,6 %. Его плотность – 2002 кг/м3.
- Аккумуляторная — 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала — диоксида свинца (PbO2), а отрицательные — из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см3), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см3, электролит – около 1,300 г/см3. Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см3.
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
Дистиллированная вода или электролит — что лучше доливать в аккумулятор?
Можно ли доливать электролит вместо дистиллята и наоборот?
Электролит и дистиллированная вода не являются взаимозаменяемыми субстанциями.
Если потребовалось залить дистиллят, пополнять АКБ нужно только им. Заменять его нельзя. Это неизбежно сократит срок службы батареи.
Если потребовалось залить электролита, пополнять АКБ нужно исключительно электролитом.
Электролит в АКБ – это смесь дистиллята и серной кислоты (в соотношении 65-35 %). Основное назначение раствора – подвести ток в момент включения двигателя и поддерживать работу автомобиля с отключенным двигателем (музыка, свет, и др.).
Смесь способна накапливать энергию и передавать электрический ток все время эксплуатации. Изготавливают ее в заводских условиях, но возможно самостоятельное приготовление.
В процессе изготовления серную кислоту (с плотностью 1,4 г/см3) перемешивают с дистиллированной водой (с плотностью 1,0 г/см3).
Итоговая плотность продукта, которая даст возможность полноценно работать батарее по своему назначению 1,27 г/см3. То есть электролит и дистиллят – это два совершенно разных вида. Объединяет их только то, что вода — неотъемлемая часть электролита.
Если при необходимости пополнить батарею дистиллятом долить в нее электролит, в результате значительно снизится плотность итоговой смеси.
Это приведет к проблемам в эксплуатации АКБ следующего типа:
- Замерзание электролитической смеси при понижении температуры наружного воздуха.

- Снижение функции накопления электрической энергии и ее передачи в необходимом объеме.
- Быстрая разрядка АКБ вследствие неполноценного выполнения работы по назначению.
Если нужно добавить в аккумуляторную батарею электролита, а при доливке использовали дистиллированную воду, плотность итоговой смеси увеличится.
Это неизбежно приведет к следующим проблемам:
- Повышенное содержание серных кислот приведет к образованию кристаллического осадка на металлические пластины сепаратора. Это поспособствует коррозии металла.
- Снизится качество работы АКБ в выполнении функций по передаче электрической энергии.
- Срок службы сократится.
Важно! Нужно помнить, что дистиллят и электролит заменять между собой нельзя! Правильный выбор продлит жизнь аккумуляторной батарее. Ошибка приведет к изъятию восстанавливаемой АКБ из пользования и покупке новой, что потребует значительных финансовых затрат.
Как определить, что необходимо?
Для точного определения, какую жидкость залить в батарею, необходимо провести диагностику. Заключаться обследование будет в выявлении причин, по которым уровень жидкости может быть снижен.
Заключаться обследование будет в выявлении причин, по которым уровень жидкости может быть снижен.
Причин может быть несколько.
Выплескивание электролита или его утечка
В этом случае нужно доливать исключительно электролит. При замене его на дистиллят плотность готовой смеси ощутимо снизится.
АКБ будет быстро разряжаться и не сможет полноценно выполнять свои функции по накоплению и передаче электрической энергии. Срок его службы значительно сократится.
Перебор воды в аккумуляторной батарее при эксплуатации в зимний период приведет к замерзанию воды и образованию наледи в верхних слоях. Это негативно скажется на работе батареи и выведет ее из эксплуатации.
Отметим, если зафиксирована именно утечка жидкости разгерметизации батареи, то лучше такую батарею не использовать.
Выкипание дистиллята
В этом случае нужен исключительно дистиллят. При постоянной эксплуатации автомобиля в условиях высокой температуры вода, находящаяся в составе электролита, неизбежно выкипает. В аккумуляторе снижается уровень. Доливая электролит, автоматически повышается плотность итоговой смеси.
В аккумуляторе снижается уровень. Доливая электролит, автоматически повышается плотность итоговой смеси.
В такой ситуации пластины сепаратора будет подвержены сульфатизации (появлению кристаллизационного осадка на металлической поверхности пластин) и их срок эксплуатации сократится ввиду быстрого износа.
Определение причины уменьшения уровня электролита заключается в измерениях его плотности. Выполнять измерение рекомендуется при температуре 15С. Замеры производить нужно во всех банках аккумулятора по отдельности. Измеряют ареометром.
Его можно относительно недорого приобрести в магазине, или взять в пользование в автосервисе:
- Если при замерах ареометром выявляют, что показатели плотности выше, чем 1,27-1,28 г/см3, можно сделать вывод о том, что часть воды в процессе эксплуатации испарилась. Именно снижение водной составляющей по отношению к серной кислоте может способствовать увеличению плотности. Чтобы довести параметры электролита до нормативных, нужно залить дистиллят.

- Если при замерах выявляют, что показатели плотности находятся в рабочем диапазоне, значит, испарения воды не происходило. Ее количество находится в норме, необходимой для выполнения всех функций АКБ. Следует пополнить банки электролитом.
Как определить необходимое количество для АКБ?
Понять, какое количество нужно для пополнения смеси электролитом (при условии, что нужен именно он) или дистиллированной водой (в аналогичном случае) можно следующими способами.
Визуально
На корпус батареи производитель наносит специальные «риски» min – max. Именно по отметкам на АКБ можно ориентироваться сколько требуется (и чего именно) добавить в смесь. Производя заливку, надо следить, чтобы требуемое количество была добавлена выше минимальной отметки, но ниже максимальной.
Если отметок на корпусе нет, то нужно доливать так, чтобы металлические пластины были покрыты на 1-1,5 см.
Инструментально
Существуют специальные мерные трубочки, с помощью которых можно замерять уровень электролитической смеси.
При отсутствии прибора можно использовать любую стеклянную или пластиковую палочку. Подойдет палочка длиной 20-25 см, толщиной 5-7 мм.
Открыв все банки, в каждой по отдельности нужно замерить уровень. Для этого опустить трубочку до упора и поднять ее. На ней четко будет видно, сколько смеси в банке АКБ.
Доливать нужно до того момента, как уровень будет определяться в высоту 1,5-2,0 см. Если дистиллированная вода долита до нужного уровня, плотность электролитической смеси восстановится в первоначальные параметры 1,27 г/см.куб. Это необходимо для обеспечения полноценной работы АКБ.
Внимание! Долив в необслуживаемых аккумуляторах не предусмотрен производителем! Доступ к банкам строго ограничен полной герметизацией корпуса.
В видео подробная информация о том, как измерить уровень электролита в аккумуляторе:
Заключение
Если уровень ощутимо понижен и не достигает отметки min, здесь нужно решать, чем пополнить оставшуюся смесь. В 95% случаев АКБ пополняют именно дистиллятом, хотя допускаются варианты. Правильное решение сможет продлить жизнь батареи, доведя ее параметры до заводских. Ошибка приведет к выводу ее из пользования.
В 95% случаев АКБ пополняют именно дистиллятом, хотя допускаются варианты. Правильное решение сможет продлить жизнь батареи, доведя ее параметры до заводских. Ошибка приведет к выводу ее из пользования.
Электролиз расплавов и растворов (солей, щелочей, кислот) / Справочник :: Бингоскул
Сильнейшим окислительно — восстановительным действием обладает электрический ток. С помощью воздействия электрического тока на вещество можно получить чистый металл. Этот метод называется электролизом.
Электролиз – процесс, при котором происходит разложение вещества электрическим током.
Процесс электролиза может протекать только в веществах, проводящих электрический ток, то есть электролитах. К электролитам относят представителей основных классов неорганических соединений – кислоты, соли, щелочи.
Для протекания процесса требуется устройство, называемое электролизером.
Данное устройство работает от внешнего источника питания, который подает электрический ток. Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Катод (-) – является отрицательно заряженным электродом, катионы ( + ) перемещаются к нему и происходит процесс восстановления.
Анод (+) – положительно заряженный электрод, к нему перемещаются анионы (-) и происходит процесс окисления.
Можно выделить два типа электролиза для расплавов и растворов. Ход этих двух процессов происходит по-разному. Зависит по большей части это от содержания воды в растворе, которая тоже принимает участие в процессе. В расплаве происходит разложение только вещества.
В расплаве происходит разложение только вещества.
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)
Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.
Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
Катионы K+ перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
- Катодный процесс: K+ + e— → K0
Анионы Cl— движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
- Анодный процесс: 2Cl— — 2e— → Cl20↑
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
- 2KCl (эл.ток) 2K0 + Cl20↑
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S—, J—, Br—, Cl—, OH— и молекулы H2O:
- 2J— => J20 + 2e;
- 4OH— => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
- Катод: 2H2O + 2e— → H2 + 2OH—
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
- Анод: 2I—— 2e— → I20
В результате можно создать общее уравнение электролиза:
- 2KI + 2H2O (эл.ток) 2KOH + I2 + H2↑
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl—
- Катод: Cu2+ + 2e— → Cu0
- Анод: Cu0 — 2e— → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
- Катод: 2H2O + 2e— → H2 + 2OH—
Молекулы воды окисляются на аноде и выделяется кислород.
- Анод: 2H2O — 4e— → O2 + 4H+
В результате получаем общее уравнение электролиза:
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
- Катод: 2H2O + 2e— → H2 + 2OH—
На аноде откладываются молекулы кислорода.
- Анод: 4OH— — 4e— → O2 + 4H+
Получаем суммарное уравнение электролиза:
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3—
- Катод: 2H+ + 2e— → H2
- Анод: 2H2O — 4e— → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
Смотри также:
Дистиллированную воду или электролит: что доливать в аккумулятор
Правильный уровень электролитической жидкости во много определяет срок службы аккумулятора. Но следить нужно и за уровнем, и за плотностью раствора серной кислоты. В статье мы ответим на вопрос, что заливать, как отличить дистиллированную воду от обычной, чтобы своими действиями не сократить ресурс АКБ.
Почему АКБ нуждается в обслуживании?
Электролит — смесь серной кислоты и дистиллированной воды, которая вступает в химическую реакцию с активной массой отрицательных и положительных пластин. При разряде свинцово-кислотного аккумулятора из электролитической жидкости расходуется серная кислота и вода, в результате чего снижается плотность электролита. При обратном процессе, когда аккумулятор заряжается, количество свинца на электродах может снизиться настолько, что внутри батареи начинает преобладать процесс электролиза воды. Описанное выше «кипение» возникает при перезаряде аккумулятора, а результатом выделения газообразного водорода и кислорода становится повышение плотности электролита.
Перезаряд опасен не только выкипанием воды, но и взрывом образующихся внутри корпуса аккумулятора газов. Поэтому нужно следить за исправностью системы зарядки автомобиля. В случае заряда от внешнего устройства следует приоткрутить сервисные пробки и правильно выставлять ток зарядки.
Подготовленный материал главным образом относится к малосурмянистым свинцово-кислотным аккумуляторам (Sb/Sb). АКБ такого типа из-за невысокой стоимости получили наибольшее распространение, но владельцам стоит помнить о недостатках: высокий саморазряд и снижение плотности вследствие вскипания воды. Некоторые кальциевые аккумуляторные батареи (Ca/Ca) также нуждаются в плановом обслуживании, что обязательно указывает производитель в инструкции по эксплуатации.
В каких случаях следует долить электролит?
- Линейный перезаряд. Причина в неисправной системе зарядки автомобиля, вследствие чего происходит вскипание электролитической жидкости. Проверить систему зарядки можно мультиметром. Уровень заряда на холостом ходу и при перегазовках не должен превышать 14,8 В. Если вы заметили на корпусе потеки и окисление на металлических поверхностях вблизи батареи, после устранения причины неисправности обязательно проверьте уровень и плотность электролитической жидкости. Продолжительная эксплуатация АКБ при перезаряде опасна оголением пластин, вследствие чего они нагреваются и теряют активную массу, происходит реакция сульфатации. На внутренней части пробок при этом можно увидеть темный налет. Лучше не пытаться оживить батарею доливкой электролита, а заменить аккумулятор.
- Течь электролита из одной из банок вследствие повреждения корпуса. Трещины, сколы чаще всего возникают из-за механических повреждений или замерзания воды внутри корпуса в сильный мороз. Если степень повреждений незначительная, корпус можно отремонтировать. В таком случае следует правильно определить соотношение электролита и дистиллированной воды в аккумуляторе. Если аккумулятор был поврежден до использования, надо залить электролит с такой же плотностью, которая осталась в поврежденной банке. Если АКБ использовался в поврежденном состоянии, долейте и электролит, и воду, сравняв плотность поврежденной и соседней секций.
- Потеря электролита вследствие переворота или опрокидывания батареи.
- Ввод в эксплуатацию сухозаряженных аккумуляторов. Данная технология производства сохранила свою актуальность только для мотоциклов. Все автомобильные аккумуляторные батареи поставляются в готовом к использованию состоянии.
Измеряем плотность и уровень электролита
Чтобы понять, вашему аккумулятору нужна вода или электролит, важно правильно определить уровень жидкости и плотность внутри каждой банки. Уровень электролита не должен опускаться ниже верхней границы пластин. Для его визуальной проверки достаточно открутить сервисные пробки.
Шаг второй – измерение плотности. На полностью заряженном аккумуляторе плотность электролитической жидкости с температурой +20 °С должна составлять 1,27-1,29. Измерения проводятся специальным прибором – ареометром. Плотность зависит от температуры электролитической жидкости, поэтому при самостоятельной проверке в условиях, разнящихся с эталонными, следует пользоваться корректирующей таблицей. Суть диагностики в том, чтобы набрать небольшое количество электролита из каждой банки, после чего оценить плотность по шкале на поплавке.
При продолжительном простое в разряженном состоянии аккумулятор следует заряжать малым током (5-7% от емкости). Большой ток зарядки приведет к реакции сульфатации. Даже при полной зарядке АКБ больше не будет соответствовать своим пусковым и емкостным характеристикам.
При сульфатации даже в заряженном состоянии плотность может не подняться выше 1,20. Такие изменения часто вводят автовладельцев в заблуждение, заставляя доливать корректирующий электролит, что неправильно. Сначала нужно провести детацию пластин. Определить можно по белому налету на пластинах.
Если реакция детации отсутствует, то показатель ниже 1,27 говорит о необходимости заливки корректирующего электролита. И наоборот, если плотность выше, следует долить в аккумулятор воды.
Выбор дистиллята
Если заправить аккумулятор обычной водой (в том числе и собранной дождевой), активная масса пластин очень быстро придет в негодность. Чтобы продлить срок эксплуатации аккумулятора, используйте только качественную дистиллированную воду. Для проверки качества учитывайте простейшие характеристики дистиллята:
- электропроводность. Дистиллированная вода, в отличие от обычной, не проводит электрический ток. Проверить воду можно путем измерения сопротивления с помощью мультиметра – у дистиллята оно будет равно бесконечности;
- отсутствие следов после вскипания. Для теста капните воду на чистый лист А4 либо нагрейте ее на стеклянной поверхности/кусочке фольги. После испарения дистиллята на поверхности не должно остаться ореолов и пятен.
Видео:КАК ДОЛИВАТЬ ЭЛЕКТРОЛИТ ИЛИ ВОДУ В АККУМУЛЯТОР | ЧТО ДЕЛАТЬ НЕЛЬЗЯ
Соотношение электролита к воде
Чтобы получить 1 литр электролитической жидкости плотностью 1,27-1,28, следует смешать 0,772 л корректирующего электролита и 0,295 л дистиллированной воды. При нормальной эксплуатации испаряется только вода, поэтому доливать электролит вместо дистиллята нельзя. Чтобы не ошибиться с плотностью, обслуживание проводят только после полной зарядки аккумулятора.
Перелив воды, при котором плотность опускается на уровень 1,26, считается некритичным. При снижении этой границы уже необходимо откачать часть жидкости, довести плотность до заводской, долив корректирующий электролит.
Меры предосторожности
Все действия с раствором серной кислоты и воды проводят в плотных резиновых перчатках. Не допускайте попадания электролита на оголенные участки кожи и слизистые оболочки. Помните о том, что раствор крайне агрессивен и к лакокрасочному покрытию автомобиля. При попадании на ЛКП обязательно промойте участки очистителем и большим количеством воды.
Сильные и слабые электролиты — степень диссоциации
Электролиты — вещества, расплавы или растворы которых могут проводить электрический ток.
Неэлектролиты — вещества, расплавы или растворы которых не могут проводить электрический ток.
Диссоциация и степень диссоциации
Диссоциация — это распад соединений на ионы.
Степень диссоциации (α) — это отношения числа продиссоциировавших, то есть распавшихся на ионы молекул к их общему числу растворенных молекул.
Формула:
Стрелкой → обозначают распад соединений на ионы.
Стрелкой ← обозначают обратный процесс.
Сильные электролиты
Сильные электролиты — это вещества, которые при растворении в воде почти полностью диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак равенства (=) для сильных электролитов.
К сильным электролитам относятся:
- Многие неорганические кислоты, такие как: h3SO4, HNO3, HClO3, HMnO4, HClO4, HBr, HCl, HI.
- Основания щелочноземельных (Ca(OH)2, Ba(OH)2, Sr(OH)2) и щелочных (KOH, NaOH, LiOH) металлов.
- Растворимые соли.
Слабые электролиты
Слабые электролиты — это такие вещества, которые только частично диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак обратимости (⇄) для слабых электролитов.
К слабым электролитам относятся:
- Вода и практически все органические кислоты.
- Некоторые неорганические кислоты: h4PO4, h3SiO3, h3S, h4PO4, HNO2, h3CO3.
- Нерастворимые гидроксиды металлов: Zn(OH)2, Mg(OH)2, Fe(OH)2.
Сильные и слабые электролиты
Как различить сильные и слабые электролиты? Сильные электролиты в растворах почти полностью диссоциированы. К данной группе в большой степени относятся соли, сильные кислоты и щелочи. Слабые электролиты включают слабые основания и кислоты, а также некоторые соли, цианид ртути (II), хлорид ртути (II), иодид кадмия и роданид железа (II).
Степень диссоциации, сильные и слабые электролиты — видео
Что такое электролиты в химии? Сильные, слабые и неэлектролиты
Электролиты — это химические вещества, которые распадаются на ионы (ионизируются) при растворении в воде. Положительно заряженные ионы называются катионами , а отрицательно заряженные ионы — анионами . Вещества можно разделить на сильных электролитов , слабых электролитов или неэлектролитов .
Сильные электролиты
Гидроксид натрия — это сильное основание и сильный электролит.(Ben Mills)Сильные электролиты полностью ионизируются в воде. Это означает, что 100% растворенного химического вещества распадается на катионы и анионы. Однако это не означает, что химическое вещество полностью растворяется в воде! Например, некоторые виды плохо растворяются в воде, но являются сильными электролитами. Это означает, что растворяется не очень много, но все, что растворяется, распадается на ионы. Примером является гидроксид стронция с сильным основанием, Sr (OH) 2 . Он имеет низкую растворимость в воде, но полностью диссоциирует на ионы Sr 2+ и OH — .В то время как колба с гидроксидом натрия (NaOH) в воде будет содержать ионы Na + и OH — в воде, но не фактический NaOH, колба с водным гидроксидом стронция будет содержать ионы Sr 2+ и OH —. , Sr (OH) 2 и вода.
Примеры : Сильные кислоты, сильные основания и соли являются сильными электролитами.
Слабые электролиты
Аммиак — слабое основание и слабый электролит. (Бен Миллс)Слабые электролиты частично ионизируются в воде.Практически любая диссоциация на ионы между 0% и 100% делает химическое вещество слабым электролитом, но на практике от 1% до 10% слабого электролита распадается на ионы.
Примеры : Слабые кислоты и слабые основания являются слабыми электролитами. Большинство азотсодержащих молекул — слабые электролиты. Некоторые источники считают воду слабым электролитом, потому что она частично диссоциирует на ионы H + и OH —, но неэлектролитом по другим источникам, потому что только очень небольшое количество воды диссоциирует на ионы.
Неэлектролиты
Если вещество вообще не ионизируется в воде, это неэлектролит.
Примеры : Большинство соединений углерода неэлектролиты. Жиры, сахара и спирты в значительной степени неэлектролиты.
Почему вам должно быть все равно?
Самая важная причина узнать, является ли химическое вещество электролитом и насколько сильно оно диссоциирует в воде, заключается в том, что вам нужна эта информация для определения химических реакций, которые могут происходить в воде.Кроме того, если у вас есть контейнер с химическим веществом в воде, неплохо узнать, растворяется ли это вещество в воде (его растворимость) и диссоциирует ли оно на ионы.
Классическим примером того, почему это важно, является раствор цианида натрия (NaCN). Вы, наверное, знаете, что цианид является реактивным и чрезвычайно токсичным, так что не могли бы вы открыть бутылку цианида натрия в воде? Если вы узнаете, что цианид натрия является солью, вы будете в безопасности (при условии, что не пьете раствор), потому что в воде нет цианида натрия, только ионы Na + и CN — в воде. .Ионы цианида не летучие и не вызывают болезней. Сравните это с бутылкой цианистого водорода (HCN) в воде. Вы бы открыли эту бутылку? Если вы узнаете, что цианистый водород является слабой кислотой, вы будете знать, что бутылка содержит газообразный цианистый водород, ионы водорода, ионы цианида и воду. Открытие этой бутылки может стоить вам жизни!
Как узнать, какие химические вещества являются электролитами?
Теперь, когда вы заинтересованы в том, чтобы узнать, что такое электролит, вы, вероятно, задаетесь вопросом, как определить, к какому типу электролита относится химическое вещество, по его названию или структуре.Вы делаете это путем исключения. Вот несколько шагов, которые необходимо выполнить, чтобы определить сильные, слабые и неэлектролиты.
- Это сильная кислота? Их всего 7 штук, и вы будете часто сталкиваться с ними по химии, так что это хороший план, чтобы их запомнить. Сильные кислоты — сильный электролит.
- Это сильная база? Это немного большая группа, чем сильные кислоты, но вы можете определить сильные основания, потому что они являются гидроксидами металлов. Любой элемент из первых двух столбцов периодической таблицы в сочетании с гидроксидом является сильным основанием.Сильные основания — сильные электролиты.
- Это соль? Соли — сильные электролиты.
- Содержит ли химическая формула азот или «N»? Это может быть слабое основание, что делает его слабым электролитом.
- Химическая формула начинается с водорода или «H»? Это может быть слабая кислота, которая делает ее слабым электролитом.
- Это соединение углерода? Большинство органических соединений не являются электролитами.
- Ничего из вышеперечисленного? Есть большая вероятность, что это неэлектролит, хотя это может быть слабый электролит.
Таблица сильных электролитов, слабых электролитов и неэлектролитов
В этой таблице обобщены группы сильных, слабых и неэлектролитов с примерами каждой категории.
| Сильные электролиты | |
| сильные кислоты | HCl (соляная кислота) |
| HBr (бромистоводородная кислота) | |
| HI (иодистоводородная кислота) | |
| 3 (азотная кислота) | |
| HClO 3 | |
| HClO 4 | |
| H 2 SO 4 (серная кислота) | |
| сильные основания | NaOH (гидроксид натрия) |
| KOH (гидроксид калия) | |
| LiOH | |
| Ba (OH) 2 | |
| Ca (OH) 2 | |
| соли | NaCl |
| KBr | |
| MgCl 2 | |
| Слабый электро лайты | |
| слабые кислоты | HF (плавиковая кислота) |
| HC 2 H 3 O 2 (уксусная кислота) | |
| H 2 CO 3 (угольная кислота) | |
| H 3 PO 4 (фосфорная кислота) | |
| слабые основания | NH 3 (аммиак) |
| (соединения «N») | C 5 H 5 N (пиридин) |
| Неэлектролиты | |
| сахара и углеводы | C 6 H 12 O 6 (глюкоза) |
| жиры и липиды | холестерин |
| спирты | C 2 H 5 OH (этиловый спирт) |
| другие соединения углерода | C 5 H 12 (ручка tane) |
Связанные сообщения
8.10.9C: Слабые и сильные электролиты
Серьезное изучение растворов электролитов началось во второй половине 19 века, в основном в Германии, и до того, как были хорошо изучены детали диссоциации и ионизации. Эти исследования показали, что все эквивалентные электропроводности электролитов уменьшаются с концентрацией (или, точнее, с квадратным корнем из концентрации), но они делают это несколькими различными способами, которые отличаются своим поведением при очень малых концентрациях.Это привело к классификации электролитов на слабые, промежуточные и сильные.
Вы заметите, что графики зависимости проводимости от √ c начинаются с c = 0. Конечно, невозможно измерить проводимость электролита при исчезающе малых концентрациях (не говоря уже о нуле!), Но для сильных и промежуточных электролитов можно экстраполировать ряд наблюдений до нуля. Результирующие значения известны как , предельные эквивалентные проводимости или иногда как «эквивалентные проводимости при бесконечном разбавлении», обозначаемые Λ °.
- Сильные электролиты
- Эти системы с хорошим поведением включают множество простых солей, таких как NaCl, а также все сильные кислоты.
Графики Λ против √c точно следуют линейной зависимости - Λ = Λ ° — б √ в
- Промежуточные электролиты
- Эти «не очень сильные» соли не могут полностью соответствовать приведенному выше линейному уравнению, но их электропроводность может быть экстраполирована на бесконечное разбавление.
- Слабые электролиты
- «Меньше значит больше» для этих странностей, обладающих замечательной способностью демонстрировать бесконечную эквивалентную проводимость при бесконечном разбавлении.Хотя Λ ° не может быть оценено экстраполяцией, есть хитрый обходной путь.
Электропроводность уменьшается с увеличением концентрации
Поскольку ионы являются носителями заряда, можно ожидать, что проводимость раствора прямо пропорциональна их концентрациям в растворе. Таким образом, если электролит полностью диссоциирован, проводимость должна быть прямо пропорциональна концентрации электролита. Но это идеальное поведение никогда не соблюдается; вместо этого проводимость электролитов всех видов уменьшается с увеличением концентрации.
Неидеальность электролитических растворов также отражается в их коллигативных свойствах, особенно в понижении точки замерзания и осмотическом давлении. Основная причина этого — присутствие ионной атмосферы, которая была введена выше. В той степени, в которой ионы, имеющие противоположные знаки заряда, с большей вероятностью будут находиться ближе друг к другу, мы ожидаем, что их заряды частично аннулируются, уменьшая их тенденцию к миграции в ответ на приложенный градиент потенциала.
Вторичный эффект возникает из-за того, что когда ион мигрирует через раствор, его противоионное облако не успевает за ним. Вместо этого новые противоионы постоянно собираются на переднем фронте движения, а уже существующие остаются на противоположной стороне. Для рассеивания потерянных противоионов требуется некоторое время, поэтому на заднем фронте всегда больше противоионов. Возникающая в результате асимметрия поля противоиона оказывает тормозящее действие на центральный ион, снижая скорость его миграции и, следовательно, его вклад в проводимость раствора.
Количественная обработка этих эффектов была впервые разработана П. Дебаем и У. Хюккелем в начале 1920-х годов и улучшена Оствальдом несколько лет спустя. Эта работа представляла собой одно из важнейших достижений физической химии в первой половине 20-го века и поставила поведение электролитических растворов на прочную теоретическую основу. Даже в этом случае теория Дебая-Хюккеля не работает для концентраций, превышающих примерно 10 –3 М л –1 для большинства ионов.
Не все электролиты полностью диссоциируют в растворе
Графики для сильных электролитов в значительной степени объясняются эффектами, рассмотренными непосредственно выше. –_ {(aq)} \]сместится влево по мере увеличения концентрации «свободных» ионов.В более разбавленных растворах фактическая концентрация этих ионов меньше, но их относительное содержание по отношению к недиссоциированной форме больше. Когда концентрация раствора приближается к нулю, практически весь \ (MX _ {(aq)} \) диссоциирует, и проводимость достигает своего предельного значения.
Слабые электролиты диссоциируют только при очень высоком разбавлении
| плавиковая кислота | HF | K a = 10 –3.2 |
| уксусная кислота | CH 3 COOH | К a = 10 –6,3 |
| бикарбонат-ион | HCO 3 — | К a = 10 –10,3 |
| аммиак | NH 3 | K b = 10 –4.7 |
Диссоциация, конечно, зависит от степени. Константы равновесия диссоциации промежуточной электролитной соли MX обычно находятся в диапазоне 1-200. Это контрастирует с большим количеством слабых кислот (а также слабых оснований), константы диссоциации которых обычно находятся в диапазоне от 10 –3 до менее 10 –10 .
Эти слабые электролиты, как и промежуточные, будут полностью диссоциировать на пределе нулевой концентрации; если бы масштаб графика слабого электролита (синий), показанный выше, был увеличен на много порядков, кривая была бы похожа на кривую для промежуточного электролита над ним, и значение для Λ ° можно было бы найти путем экстраполяции.Но при таком высоком разбавлении проводимость была бы настолько незначительной, что она была бы замаскирована проводимостью самой воды (то есть ионами H + и OH —, находящимися в равновесии с массивным 55,6 ML -1 концентрация воды), что делает значения Λ в этой области практически неизмеримыми.
Авторы и авторство
Через этот сайт мы ищем исторические материалы относящиеся к топливным элементам.Мы построили площадку для сбора информация от людей, уже знакомых с технологиями, таких как изобретатели, исследователи, производители, электрики и маркетологи. Этот раздел Основы представляет общий обзор топливных элементов для случайных посетителей. Что такое топливный элемент? Топливный элемент — это устройство, генерирующее электричество путем химической реакции. Каждый топливный элемент имеет два электрода, называемых соответственно анодом и катодом.На электродах происходят реакции, производящие электричество. Каждый топливный элемент также имеет электролит, который несет электрически заряженные частицы. от одного электрода к другому, и катализатор, который ускоряет реакции на электроды. Основным топливом является водород, но топливным элементам также нужен кислород. Одно большое обращение топливные элементы заключается в том, что они вырабатывают электричество с очень небольшим загрязнением — большая часть водород и кислород, используемые для производства электроэнергии, в конечном итоге объединяются, чтобы сформировать безвредный побочный продукт, а именно вода. Одна деталь терминологии: один топливный элемент генерирует крошечное количество прямого ток (DC) электричество. На практике многие топливные элементы обычно собираются в стек. Ячейка или стопка, принципы те же. Верх Как работают топливные элементы? Топливный элемент предназначен для выработки электрического тока, который может быть направлен вне клетки для выполнения работы, такой как включение электродвигателя или освещение лампочка или город.Из-за того, как ведет себя электричество, этот ток возвращается к топливный элемент, замыкая электрическую цепь. (Чтобы узнать больше об электричестве и электроэнергии, посетите страницу «Throw The Switch» на сайте Смитсоновского института Powering a Генерация изменений.) Химические реакции, которые производят этот ток, являются ключевыми. как работает топливный элемент. Существует несколько видов топливных элементов, каждый из которых работает по-своему. Но в общие термины: атомы водорода попадают в топливный элемент на аноде, где происходит химическая реакция лишает их электронов.Атомы водорода теперь «ионизированы» и несут положительный электрический заряд. Отрицательно заряженные электроны обеспечивают ток через провода делать работу. Если необходим переменный ток (AC), DC выход топливного элемента должен быть направлен через устройство преобразования, называемое инвертор.
Кислород попадает в топливный элемент на катод, а в некоторых типах ячеек (например, показанный выше) он объединяет с электронами, возвращающимися из электрическая цепь и ионы водорода, которые прошли через электролит из анод.В других типах клеток кислород захватывает электроны, а затем проходит через них. электролит к аноду, где он соединяется с ионами водорода. Электролит играет ключевую роль. Он должен пропускать только соответствующие ионы. между анодом и катодом. Если бы свободные электроны или другие вещества могли путешествовать через электролит они нарушили бы химическую реакцию. Будь то соединяются на аноде или катоде, вместе водород и кислород образуют воду, которая стекает из клетки.Пока топливный элемент снабжен водородом и кислородом, он будет генерировать электричество. Еще лучше, поскольку топливные элементы создают электричество химическим путем, а не путем сжигания, они не подчиняются термодинамическим законам, которые ограничивают обычную электростанцию (см. «Предел Карно» в глоссарии). Следовательно, топливные элементы более эффективны в извлечение энергии из топлива. Также можно использовать отработанное тепло от некоторых клеток, еще больше повышая эффективность системы. Верх Так почему я не могу пойти и купить топливный элемент? Возможно, несложно проиллюстрировать основные принципы работы топливного элемента. Но строительство недорогие, эффективные и надежные топливные элементы — дело гораздо более сложное. Ученые и изобретатели разработали множество различных типов и размеров топливных элементов. в поисках большей эффективности, и технические детали каждого типа различаются. Многие из вариантов, с которыми сталкиваются разработчики топливных элементов, ограничиваются выбором электролит.Например, конструкция электродов и материалы, из которых изготовлены они зависят от электролита. Сегодня основными типами электролитов являются щелочные, расплавленные. карбонат, фосфорная кислота, протонообменная мембрана (PEM) и твердый оксид. Первый три — жидкие электролиты; последние два — твердые тела. Тип топлива также зависит от электролита. Некоторым клеткам нужен чистый водород, и поэтому требуется дополнительное оборудование, такое как «риформер», для очистки топлива.Другие клетки может переносить некоторые примеси, но для эффективной работы может потребоваться более высокая температура. В некоторых ячейках циркулируют жидкие электролиты, для чего требуются насосы. Тип электролит также определяет рабочую температуру ячейки — «расплавленные» карбонатные ячейки работают горячий, как следует из названия. Каждый тип топливных элементов имеет преимущества и недостатки по сравнению с другими, и ни один все же достаточно дешев и эффективен, чтобы широко заменить традиционные способы генерации электростанции, например угольные, гидроэлектростанции или даже атомные электростанции. В следующем списке описаны пять основных типов топливных элементов. Более подробный информацию можно найти в этих конкретных областях этого сайта. Верх Различные типы топливных элементов.
Фосфорная кислота Топливные элементы (PAFC) используют фосфорную кислоту в качестве электролита. КПД составляет от 40 до 80 процентов, а рабочая температура — от 150 до 200 градусов по Цельсию (от 300 до 400 градусов по Фаренгейту). Существующие клетки фосфорной кислоты имеют мощностью до 200 кВт, испытаны блоки мощностью 11 МВт. PAFCs терпят углерод концентрация монооксида около 1.5 процентов, что расширяет выбор топлива, которое они можно использовать. Если используется бензин, необходимо удалить серу. Платиновые электроды-катализаторы необходимы, а внутренние части должны выдерживать воздействие коррозионной кислоты.
Протонообменная мембрана (PEM) топливные элементы работают с полимерным электролитом в виде тонкого проницаемого листа.КПД составляет от 40 до 50 процентов, а рабочая температура составляет около 80 градусов Цельсия. (около 175 градусов по Фаренгейту). Мощность ячеек обычно составляет от 50 до 250 кВт. Твердый, гибкий электролит не протекает и не трескается, и эти элементы работают при достаточно низкой температура, чтобы сделать их пригодными для дома и автомобилей. Но их топливо должно быть очищено, Платиновый катализатор используется с обеих сторон мембраны, что увеличивает затраты.
Более подробная информация о каждом типе топливных элементов, включая историю и текущие приложения можно найти в соответствующих разделах этого сайта.У нас также есть предоставлен глоссарий технических терминов — ссылка находится вверху каждого страница технологий. Верх © 2017 Смитсоновский институт |
Анализ крови на электролиты — результаты, причины дисбаланса электролитов, симптомы
Электролиты — это химические вещества, которые проводят электричество при смешивании с водой.Важные электролиты в организме человека включают
- Натрий
- Калий
- Кальций
- Бикарбонат
- Магний
- Хлорид
- Фосфат
Электролиты важны для множества функций организма, включая гидратацию тела, регулирование функции нервов и мышц, балансирование кислотности крови и уровней давления, а также восстановление поврежденных тканей. Анализ крови на электролиты используется для выявления проблем, вызванных дисбалансом электролитов в организме.
Различные функции различных электролитов в организме
Электролиты — это в основном минералы, обнаруженные в тканях и крови организма в виде растворенных солей. Они помогают прохождению питательных веществ в клетки тела и перемещению продуктов жизнедеятельности из них. Электролиты также помогают поддерживать здоровый водный баланс в организме и регулируют уровень pH в организме. Вот некоторые из важных функций различных электролитов в организме
- Натрий: Этот электролит обычно присутствует на внеклеточном уровне организма.Это помогает регулировать количество воды в организме.
- Калий: Этот электролит присутствует в клетках организма и важен для регулирования сердечного ритма и функции мышц. Он также играет важную роль в передаче нейронов.
- Кальций: Это самый распространенный минерал в организме, он важен для образования костей и зубов, а также для передачи нервных импульсов, свертывания крови и сокращения мышц.
- Бикарбонат: Он играет важную роль в поддержании уровня pH в организме.
- Магний: Это важный электролит, который играет важную роль в поддержании нормальной функции нервов и мышц, укреплении иммунной системы организма, поддержании стабильной частоты сердечных сокращений, стабилизации уровня сахара в крови и содействии формированию костей и зубов.
- Хлорид: Он тесно взаимодействует с натрием для поддержания надлежащего баланса и давления в различных жидкостях тела, включая кровь, внутриклеточную жидкость и межклеточную жидкость.
- Фосфат: Этот электролит важен для производства энергии в элементах. Он необходим для роста и восстановления тканей и является важным строительным блоком для клеточных мембран и ДНК.
Причины дисбаланса электролитов
К причинам дисбаланса электролитов относятся
- Болезни почек или почек
- Сильное обезвоживание
- Плохая диета
- Длительные периоды рвоты и диареи
- Нарушение баланса кислот и щелочей в организме
- Застойная сердечная недостаточность
- Чрезмерное употребление диуретиков
- Химиотерапия
- Старение
Симптомы электролитного дисбаланса
Симптомы дисбаланса электролитов зависят от того, какой из электролитов в организме не сбалансирован, и от того, высокая или низкая концентрация электролита.Высокая концентрация магния, натрия, калия или кальция вызывает у пациента следующие симптомы
Избыточный уровень кальция может наблюдаться у пациентов, страдающих раком груди, раком легких и множественной миеломой. В этих случаях избыток кальция вызван разрушением костной ткани. Признаки и симптомы чрезмерного уровня кальция в организме включают
- Повышенная частота мочеиспускания
- Вялость и утомляемость
- Настроение и раздражительность
- Тошнота и рвота
- Чрезмерная жажда
- Сухость во рту и горле
- Потеря аппетита
- Запор
- Боль в животе
- Нерегулярное сердцебиение
- Крайняя слабость мышц
- Кома
Почему проводится тестирование электролитов?
Анализ электролитов может проводиться как часть обычных анализов крови или если ваш врач считает, что у вас дисбаланс любого из электролитов.Обычно это натрий или калий, или если подозревается дисбаланс pH.
Анализ крови на электролиты полезен при оценке случаев, когда подозревается заболевание почек, высокое кровяное давление или сердечная недостаточность, а также для проверки эффективности проводимого лечения. Также проверяется уровень электролитов, если вы регулярно принимаете диуретики или ингибиторы АПФ.
Значение анализа крови на электролиты
Анализ крови на электролитыАнализ крови на электролиты, также известный как Анализ крови на электролитную панель , представляет собой тест, проводимый для оценки уровней основных электролитов.Обычно предписывается дать врачу представление о возможном дисбалансе электролитов, который может вызывать различные состояния здоровья.
Образец крови для теста собирается путем введения иглы в вену на руке пациента, и не требует специальной подготовки со стороны пациента перед тестом.
Интерпретация результатов анализа крови на электролиты
Повышенный уровень электролита, обнаруженный в результатах теста, может указывать на
- Метаболический ацидоз или респираторный ацидоз
- Острая или хроническая почечная недостаточность
- Болезнь Аддисона
- Обезвоживание
- Дефицит инсулина
- Распространенное внутреннее или внешнее разрушение клеток, вызванное основным заболеванием
Кроме того, иногда уровень электролитов может быть высоким, если женщина беременна.
Пониженный уровень электролита может указывать на
- Метаболический алкалоз или респираторный алкалоз
- Чрезмерное выведение электролитов почками
- Повышенный уровень инсулина в крови
Ненормальные уровни определенного электролита могут указывать на определенные состояния здоровья в зависимости от исследуемой клинической ситуации. Результаты только этого теста не должны использоваться для диагностики заболевания, но должны быть сопоставлены с клиническими данными и дополнительными тестами и информацией, чтобы прийти к окончательному диагнозу.
Факторы, которые могут повлиять на результаты теста электролита
Тестирование электролитаОпределенные факторы, такие как беременность, потребление продуктов, богатых электролитами, например энергетических напитков, и некоторых лекарств могут повлиять на результаты теста.
Всегда важно сообщать врачу о своей диете и приеме лекарств, чтобы помочь ему правильно интерпретировать результаты ваших анализов и избежать любых шансов поставить неверный диагноз.
Если уровень одного электролита окажется слишком высоким или слишком низким в анализе крови электролитов , врач назначит повторные тесты до тех пор, пока несбалансированный уровень электролита не вернется к норме.Кроме того, при обнаружении кислотно-щелочного дисбаланса врач может попросить вас сдать анализ газов крови.
Эти тесты помогают измерить уровень кислотности, кислорода и углекислого газа в образце крови из артерии. Врач также назначит повторение анализов, если для вашего состояния были прописаны определенные лекарства, такие как диуретики и ингибиторы АПФ, которые, как известно, влияют на уровень электролитов.
Я опытный писатель-медик / научный писатель, стремящийся помочь людям жить счастливой и здоровой жизнью.Моя жажда письма преследовала меня на протяжении многих лет — она присутствует, когда я просыпаюсь, задерживаясь на краю своего сознания в течение дня, и дразнит меня ночью, когда я засыпаю.
Инъекции аминокислот: показания, побочные эффекты, предупреждения
Общее название: Amino Acid Injection (идентификатор MEE noe AS в JEK shun)
Фирменное наименование: AminoProtect, Aminosyn II, Aminosyn II / Electrolytes, Aminosyn M, Aminosyn, … показать все 40 торговых марок.Aminosyn-HBC, Aminosyn-PF, Aminosyn-RF, Aminosyn / Электролиты, Clinimix E / Декстроза (2,75 / 10), Clinimix E / Декстроза (2,75 / 5), Clinimix E / Декстроза (4,25 / 10), Clinimix E / Декстроза (4,25 / 25), Clinimix E / декстроза (4,25 / 5), Clinimix E / декстроза (5/15), Clinimix E / декстроза (5/20), Clinimix E / декстроза (5/25), Clinimix N14G30E, Clinimix N9G15E, Clinimix N9G20E, Clinimix / Декстроза (2,75 / 5), Clinimix / Dextrose (4,25 / 10), Clinimix / Dextrose (4,25 / 20), Clinimix / Dextrose (4,25 / 25), Clinimix / Dextrose (4,25 / 5), Clinimix / Декстроза (5/15), Clinimix / Dextrose (5/20), Clinimix / Dextrose (5/25), Clinisol SF, FreAmine HBC, FreAmine III, гепатамин, нефрамин, пленамин, премасол, просол, синтамин 17, травазол , TrophAmine, Трофамин
Медицинское заключение компании Drugs.com. Последнее обновление: 1 ноября 2020 г.
Использование инъекций аминокислот:
- Применяется для питания организма.
Что мне нужно сказать своему врачу, прежде чем я приму инъекцию аминокислот?
- Если у вас аллергия на инъекции аминокислот; любая часть введения аминокислоты; или любые другие лекарства, продукты питания или вещества. Расскажите своему врачу об аллергии и какие у вас были признаки.
- Если у вас есть какие-либо из этих проблем со здоровьем: высокий уровень аммиака в крови, низкий объем крови, проблемы с метаболизмом некоторых аминокислот, кислота в крови или проблемы с электролитом, или слишком много жидкости в легких.
- Если у вас есть какие-либо из этих проблем со здоровьем: заболевание почек или заболевание печени.
- Если у вас проблемы с мочеиспусканием.
Это не список всех лекарств или проблем со здоровьем, которые взаимодействуют с инъекцией аминокислот.
Расскажите своему врачу и фармацевту обо всех своих лекарствах (рецептурных или безрецептурных, натуральных продуктах, витаминах) и проблемах со здоровьем. Вы должны проверить чтобы убедиться, что для вас безопасно принимать инъекции аминокислот со всеми вашими лекарствами и проблемами со здоровьем.Не начинать, не останавливать и не изменять дозу любой препарат без консультации с врачом.
Что мне нужно знать или делать, пока я принимаю инъекции аминокислот?
- Сообщите всем своим поставщикам медицинских услуг, что вы делаете инъекции аминокислот. Сюда входят ваши врачи, медсестры, фармацевты и стоматологи.
- Сдайте анализ крови в соответствии с указаниями врача. Поговорите с доктором.
- Если у вас аллергия на сульфиты, проконсультируйтесь с врачом.Некоторые продукты содержат сульфиты.
- Это лекарство может содержать алюминий. Если вы длительное время принимаете инъекции аминокислот, существует вероятность отравления алюминием. Риск возрастет, если вы есть проблемы с почками. Риск также выше у недоношенных детей. Поговорите с доктором.
- Это лекарство можно смешивать с парентеральным питанием (PN). Сгустки крови в легких, инфекции, высокий уровень сахара в крови и проблемы с печенью случилось с ПН. Иногда случаются летальные исходы от тромбов в легких.Если возникнут вопросы, поговорите с врачом.
- Если в этом продукте содержится декстроза и у вас повышенный уровень сахара в крови (диабет), проконсультируйтесь с врачом.
- Если вам 65 лет и старше, используйте инъекции аминокислот с осторожностью. У вас может быть больше побочных эффектов.
- С осторожностью применять у детей. Поговорите с доктором.
- Сообщите своему врачу, если вы беременны или планируете забеременеть. Вам нужно будет рассказать о преимуществах и рисках использования инъекций аминокислот. пока вы беременны.
- Сообщите своему врачу, если вы кормите грудью. Вам нужно будет поговорить о любых рисках для вашего ребенка.
Как лучше всего принимать это лекарство (инъекции аминокислот)?
Используйте инъекции аминокислот в соответствии с предписаниями врача. Прочтите всю предоставленную вам информацию. Внимательно следуйте всем инструкциям.
- Его вводят в вену в течение определенного периода времени.
Что мне делать, если я пропустил дозу?
- Позвоните своему врачу, чтобы узнать, что делать.
По поводу каких побочных эффектов мне нужно немедленно позвонить своему врачу?
ПРЕДУПРЕЖДЕНИЕ / ВНИМАНИЕ: хотя это может быть редким явлением, у некоторых людей могут возникать очень тяжелые, а иногда и смертельные побочные эффекты при приеме лекарства. Сказать твоему Если у вас есть какие-либо из следующих признаков или симптомов, которые могут быть связаны с очень серьезным побочным эффектом, немедленно обратитесь за медицинской помощью:
- Признаки аллергической реакции, например, сыпь; крапивница; зуд; красная, опухшая, покрытая волдырями или шелушащаяся кожа с лихорадкой или без нее; хрипы; стеснение в груди или горле; затрудненное дыхание, глотание или разговор; необычная охриплость; или отек рта, лица, губ, языка, или горло.
- Признаки проблем с жидкостью и электролитами, такие как изменение настроения, спутанность сознания, мышечная боль или слабость, сердцебиение, которое кажется ненормальным, очень сильное головокружение или обморок, учащенное сердцебиение, усиление жажды, судороги, чувство сильной усталости или слабости, отсутствие чувства голода, невозможность мочеиспускания или изменение состояния количество выделяемой мочи, сухость во рту, сухость в глазах или очень сильное расстройство желудка или рвота.
- Признаки повышенного уровня аммиака, такие как ненормальное сердцебиение, ненормальное дыхание, чувство замешательства, бледность кожи, замедление сердцебиение, судороги, потливость, рвота или подергивание.
- Признаки проблем с печенью, такие как темная моча, чувство усталости, отсутствие голода, расстройство желудка или боли в животе, светлый стул, рвота или желтая кожа или глаза.
- Признаки высокого или низкого кровяного давления, такие как сильная головная боль или головокружение, потеря сознания или изменение зрения.
- Изменение цвета кожи на синеватый, как на губах, ногтевом ложа, пальцах рук или ног.
- Сильно потеет.
- Одышка, сильное увеличение веса или отек рук или ног.
- Боль в груди.
- Кашляет кровью.
- Лихорадка или озноб.
- Это лекарство может вызвать раздражение вены. Если лекарство вытекает из вены, оно также может вызвать раздражение в этой области. Скажите медсестре, если вы есть покраснение, жжение, боль, отек или утечка жидкости в том месте, где лекарство попадает в ваше тело.
Какие еще побочные эффекты у инъекций аминокислот?
Все препараты могут вызывать побочные эффекты.Однако у многих людей побочные эффекты отсутствуют или наблюдаются лишь незначительные побочные эффекты. Позвоните своему врачу или обратитесь за медицинской помощью поможет, если у вас есть побочные эффекты, которые вас беспокоят или не проходят.
Это не все возможные побочные эффекты. Если у вас есть вопросы о побочных эффектах, позвоните своему врачу. Позвоните своему врачу за медицинской помощью совет о побочных эффектах.
Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-332-1088. Вы также можете сообщить о побочных эффектах на https: // www.fda.gov/medwatch.
Если есть подозрение на ПЕРЕДОЗИРОВКУ:
Если вы считаете, что произошла передозировка, немедленно позвоните в токсикологический центр или обратитесь за медицинской помощью. Будьте готовы рассказать или показать, что было взяли, сколько и когда это произошло.
Как мне хранить и / или выбрасывать инъекции аминокислот?
- Если вам нужно хранить инъекции аминокислот дома, поговорите со своим врачом, медсестрой или фармацевтом о том, как их хранить.
Использование информации для потребителей
- Если ваши симптомы или проблемы со здоровьем не улучшаются или ухудшаются, позвоните своему врачу.
- Не делитесь своими лекарствами с другими и не принимайте чужие лекарства.
- Храните все лекарства в надежном месте. Храните все лекарства в недоступном для детей и домашних животных месте.
- Выбросьте неиспользованные или просроченные лекарства. Не сливайте воду в унитазе или в канализацию, если вам не сказали об этом.Свяжитесь со своим фармацевт, если у вас есть вопросы о том, как лучше всего выбросить лекарства. В вашем районе могут быть программы возврата наркотиков.
- Некоторые препараты могут иметь еще один информационный буклет для пациента. Проконсультируйтесь с фармацевтом. Если у вас есть какие-либо вопросы об инъекциях аминокислот, обращайтесь с вашим врачом, медсестрой, фармацевтом или другим поставщиком медицинских услуг.
- Если вы считаете, что произошла передозировка, немедленно позвоните в токсикологический центр или обратитесь за медицинской помощью.



 Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.

