Строение и функции белков — конспект
Вернуться к теме «Строение и функции белков»
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группа h3N–, которая обладает свойствами основания; справа — группа –COOH — кислотная, характерная для всех органических кислот. Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае –
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация. Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура).
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу. Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка. Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы: А – первичная; Б – вторичная; В – третичная; Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
- Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
- Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
- Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Денатурация и ренатурация белков
Денатурация – это утрата белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жестких условиях – и первичной структуры. В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
Функции белков
1. Каталитическая (ферментативная) функция:
Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т.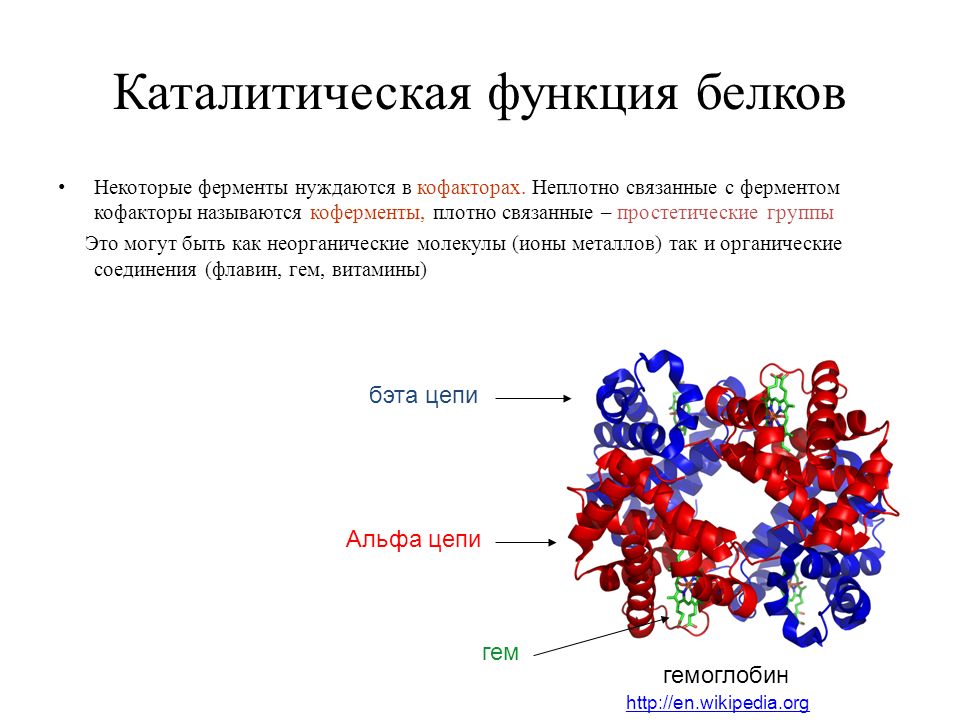
2. Транспортная функция
Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
3. Защитная функция
Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Двигательная (сократительная) функция
Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения.
5. Структурная (строительная, пластическая) функция
Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон. Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин. В состав связок, стенок артерий и лёгких входит структурный белок эластин.
6. Сигнальная (рецепторная) функция
Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку.
7. Регуляторная функция
Некоторые белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
8. Запасающая (питательная) функция
В семенах растений запасаются резервные белки, которые используются при прорастании зародышем.
9. Энергетическая функция
При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Белок может произвольно менять структуру
Секрет «успеха» вредных бактерий – в белках-трансформерах, выяснили американские учёные
Молекулы белков могут самопроизвольно менять свою структуру и приобретать новые функции, утверждают микробиологи Университета штата Огайо. В этом, в частности, заключается секрет распространения некоторых опасных болезней.
Существование альфа-, бета- и других форм одинаковых по своему химическому составу протеинов – давно известный факт. До сих пор учёные считали, что эти формы не могут переходить друг в друга. Однако наблюдения за белком RfaH, отвечающим за считывание генов у бактерий, показали, что он меняет свою форму по мере перехода процесса на новую стадию.
«Это как взять и распустить связанный свитер, чтобы связать другой свитер с другим рисунком», – говорит руководитель исследования, профессор Ирина Арцимович.
Основная функция белка RfaH состоит в прикреплении к молекуле ДНК
энзима РНК-полимеразы, которая за счёт соприкосновения
нуклеотидов обеспечивает считывание гена. И вот в ходе наблюдений
под микроскопом биологи заметили новый этап его «деятельности»: в
определённый момент молекулы RfaH отделяются от ДНК, но остаются
связанными с РНК-полимеразой, а также «призывают» к себе рибосомы
– клеточные органоиды, в которых происходит биосинтез других
белков. Так фаза воспроизводства генетического материала,
называемая транскрипцией, сменяется фазой трансляции.
Так фаза воспроизводства генетического материала,
называемая транскрипцией, сменяется фазой трансляции.
Однако обычно на этом этапе с рибосомами взаимодействуют другие вещества – информационные, или матричные РНК, несущие своеобразную программу создания той или иной белковой молекулы. Получается, что в ряде случаев RfaH берёт на себя их функции, и при этом ему приходится совершать определённые движения, изменяя свою пространственную структуру.
Для бактерий, по словам Ирины Арцимович, данный парадокс имеет особое значение: как известно, они не имеют ядра, и потому считывание некоторых генов – как правило, тех, которыми обусловлены их болезнетворные свойства – затруднено. Так что именно белок RfaH с его удивительными способностями оказывается ответственным за распространение ряда болезней.
Выводы специалистов из Колумбуса уже подтверждены рядом других лабораторий. Арцимович и её коллеги планируют продолжать изучение данного молекулярного механизма. По их мнению, есть и другие белки, которые ведут себя таким же образом – в частности, прионы, вызывающие опасное заболевание мозга у человека и крупных животных – губчатую энцефалопатию, известную также как болезнь Крейтцфельдта-Якоба или коровье бешенство.
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
- Главная
-
Университет
- Об университете
- Структура
- Нормативные документы и процедуры
- Лечебная деятельность
- Международное сотрудничество
-
Пресс-центр
- Новости
- Анонсы
- События
- Объявления и поздравления
- Online конференции
-
Фотоальбом
- Международный конкурс «Здоровый образ жизни глазами разных поколений»
- Вручение нагрудного знака «Жена пограничника»
-
Встреча с представителями медуниверситета г.
 Люблина
Люблина
- Королева Студенчества ГрГМУ — 2021
- День открытых дверей-2021
- Управление личными финансами (встреча с представителями «БПС-Сбербанк»)
- Весенний «Мелотрек»
- Праздничный концерт к 8 Марта
- Диалоговая площадка с председателем Гродненского облисполкома
- Расширенное заседание совета университета
- Гродно — Молодежная столица Республики Беларусь-2021
- Торжественное собрание, приуроченное к Дню защитника Отечества
- Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты
- Новогодний ScienceQuiz
- Финал IV Турнира трех вузов ScienseQuiz
- Областной этап конкурса «Студент года-2020″
- Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения»
- Студент года — 2020
- День Знаний — 2020
- Церемония награждения лауреатов Премии Правительства в области качества
- Военная присяга
- Выпускной лечебного факультета-2020
- Выпускной медико-психологического факультета-2020
- Выпускной педиатрического факультета-2020
- Выпускной факультета иностранных учащихся-2020
- Распределение — 2020
- Стоп коронавирус!
- Навстречу весне — 2020
- Профориентация — 18-я Международная специализированная выставка «Образование и карьера»
- Спартакиада среди сотрудников «Здоровье-2020″
- Конференция «Актуальные проблемы медицины»
- Открытие общежития №4
- Встреча Президента Беларуси со студентами и преподавателями медвузов
- Новогодний утренник в ГрГМУ
-
XIX Республиканская студенческая конференция «Язык.
 Общество. Медицина»
Общество. Медицина»
- Alma mater – любовь с первого курса
- Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике
- Областной этап «Студент года-2019″
- Финал Science Qiuz
- Конференция «Актуальные проблемы психологии личности и социального взаимодействия»
- Посвящение в студенты ФИУ
- День Матери
- День открытых дверей — 2019
- Визит в Азербайджанский медицинский университет
- Семинар-тренинг с международным участием «Современные аспекты сестринского образования»
- Осенний легкоатлетический кросс — 2019
- 40 лет педиатрическому факультету
- День Знаний — 2019
- Посвящение в первокурсники
- Акция к Всемирному дню предотвращения суицида
- Турслет-2019
- Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы
- День Независимости
- Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии»
- Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019
- Выпускной медико-психологического факультета — 2019
- Выпускной лечебного факультета — 2019
- В добрый путь, выпускники!
- Распределение по профилям субординатуры
- Государственные экзамены
- Интеллектуальная игра «Что? Где? Когда?»
- Мистер и Мисс факультета иностранных учащихся-2019
- День Победы
- IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава»
- Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!»
- Литературно-художественный марафон «На хвалях спадчыны маёй»
- День открытых дверей-2019
- Их имена останутся в наших сердцах
- Областной этап конкурса «Королева Весна — 2019″
- Королева Весна ГрГМУ — 2019
-
Профориентация «Абитуриент – 2019» (г.
 Барановичи)
Барановичи)
- Мероприятие «Карьера начинается с образования!» (г. Лида)
- Итоговое распределение выпускников — 2019
- «Навстречу весне — 2019″
- Торжественная церемония, посвященная Дню защитника Отечества
- Торжественное собрание к Дню защитника Отечества — 2019
- Мистер ГрГМУ — 2019
- Предварительное распределение выпускников 2019 года
- Митинг-реквием у памятника воинам-интернационалистам
- Профориентация «Образование и карьера» (г.Минск)
- Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета
- Спартакиада «Здоровье — 2019»
- Итоговая научно-практическая конференция «Актуальные проблемы медицины».
- Расширенное заседание Совета университета.
- Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы»
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- XVI съезд хирургов Республики Беларусь
- Итоговая практика
- Конкурс «Студент года-2018»
- Совет университета
- 1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.)
- 1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.)
- День знаний
- День независимости Республики Беларусь
- Церемония награждения победителей конкурса на соискание Премии СНГ
- День герба и флага Республики Беларусь
- «Стань донором – подари возможность жить»
- VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед»
- Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018»
- Окончательное распределение выпускников 2018 года
- Митинг-реквием, приуроченный к 75-летию хатынской трагедии
- Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год»
- Конкурсное шоу-представление «Мистер ГрГМУ-2018»
- Предварительное распределение выпускников 2018 года
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- II Съезд учёных Республики Беларусь
- Круглый стол факультета иностранных учащихся
- «Молодежь мира: самобытность, солидарность, сотрудничество»
- Заседание выездной сессии Гродненского областного Совета депутатов
- Областной этап республиканского конкурса «Студент года-2017»
- Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым
-
Конференция «Актуальные вопросы инфекционной патологии», 27.
 10.2017
10.2017
- XIX Всемирный фестиваль студентов и молодежи
- Республиканская научно-практическая конференция «II Гродненские аритмологические чтения»
- Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения»
- Праздник, посвящённый 889-летию города Гродно
- Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017)
- ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве
- 1 сентября — День знаний
- Итоговая практика на кафедре военной и экстремальной медицины
- Квалификационный экзамен у врачей-интернов
- Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь
- Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем»
- День государственного флага и герба
- 9 мая
- Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ»
- «Стань донором – подари возможность жить»
- «Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию
- Весенний кубок КВН «Юмор–это наука»
- Мисс ГрГМУ-2017
- Распределение 2017 года
- Общегородской профориентационный день для учащихся гимназий, лицеев и школ
- Праздничный концерт, посвященный Дню 8 марта
- Конкурсное шоу-представление «Мистер ГрГМУ–2017»
- «Масленица-2017»
- Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества
-
Лекция профессора, д.
 м.н. О.О. Руммо
м.н. О.О. Руммо
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань
- Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ
- «Студент года-2016»
- Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- День матери в ГрГМУ
- Итоговая практика-2016
- День знаний
- Визит китайской делегации в ГрГМУ
- Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша)
- Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника
- Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию
- Республиканская университетская суббота-2016
- Республиканская акция «Беларусь против табака»
- Встреча с поэтессой Яниной Бокий
- 9 мая — День Победы
- Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь
- Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память»
- «Цветы Великой Победы»
- Концерт народного ансамбля польской песни и танца «Хабры»
- Суботнiк ў Мураванцы
- «Мисс ГрГМУ-2016»
- Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ»
- Визит иностранной делегации из Медицинского совета Мальдивской Республики
- «Кубок ректора Гродненского государственного медицинского университета по дзюдо»
- «Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь
- Распределение выпускников 2016 года
- Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ
- Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан
- Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ
- Состоялось открытие фотовыставки «По следам Библии»
- «Кубок декана» медико-диагностического факультета по скалолазанию
- Мистер ГрГМУ-2016
- Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ
- Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года
- Визит Посла Республики Индия в УО «ГрГМУ»
- Торжественное собрание и концерт, посвященный Дню защитника Отечества
- Митинг-реквием, посвященный Дню памяти воинов-интернационалистов
- Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома
- Итоговая научно-практическая конференция Гродненского государственного медицинского университета
- Новогодний концерт
- Открытие профессорского консультативного центра
- Концерт-акция «Молодёжь против СПИДа»
- «Студент года-2015»
- Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича
- «Аlma mater – любовь с первого курса»
- Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб
- «Открытый Кубок по велоориентированию РЦФВиС»
-
Совместное заседание Советов университетов г.
 Гродно
Гродно
- Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко
- День города
- Дебаты «Врач — выбор жизни»
- День города
- Праздничный концерт «Для вас, первокурсники!»
- Акция «Наш год – наш выбор»
- День знаний
- Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет»
- Принятие военной присяги студентами ГрГМУ
- День Независимости Республики Беларусь
- Вручение дипломов выпускникам 2015 года
- Республиканская олимпиада студентов по педиатрии
- Открытие памятного знака в честь погибших защитников
- 9 мая
- «Вторая белорусско-польская дерматологическая конференция: дерматология без границ»
- Мистер университет
- Мисс универитет
- КВН
- Гродненский государственный медицинский университет
- Чествование наших ветеранов
- 1 Мая
- Cовместный субботник
- Наши издания
- Медицинский календарь
- Университет в СМИ
- Видео-презентации
- Общественные объединения
- Комиссия по противодействию коррупции
- Образовательная деятельность
- Абитуриентам
- Студентам
- Выпускникам
- Слайдер
- Последние обновления
- Баннеры
- Иностранному гражданину
- Научная деятельность
- Поиск
§ 9.
 Физико-химические свойства белков
Физико-химические свойства белков§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Таблица 4
Молекулярные характеристики некоторых белков
|
Белок |
Относитель-ная молекулярная масса |
Число цепей |
Число аминокислотных остатков |
|
Инсулин |
5733 |
2 |
51 |
|
Рибонуклеаза |
13683 |
1 |
124 |
|
Миоглобин |
16890 |
1 |
153 |
|
Химотрипсин |
22600 |
3 |
241 |
|
Гемоглобин |
64500 |
4 |
574 |
|
Глутамат-дегидрогеназа |
~1000000 |
~40 |
~8300 |
В молекулах белков может содержаться самое разное количество аминокислотных остатков — от 50 и до нескольких тысяч; относительные молекулярные массы белков также сильно колеблются — от нескольких тысяч (инсулин, рибонуклеаза) до миллиона (глутаматдегидрогеназа) и более. Число полипептидных цепей в составе белков может составлять от единицы до нескольких десятков и даже тысяч. Так, в состав белка вируса табачной мозаики входит 2120 протомеров.
Число полипептидных цепей в составе белков может составлять от единицы до нескольких десятков и даже тысяч. Так, в состав белка вируса табачной мозаики входит 2120 протомеров.
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
.
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
.
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
|
Белок |
pI |
|
Пепсин |
1,0 |
|
Каталаза |
5,1 |
|
Рибонуклеаза |
7,8 |
|
Лизоцим |
11,0 |
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
В изоэлектрической точке растворимость белка минимальна, так как его молекулы в таком состоянии электронейтральны и между ними нет сил взаимного отталкивания, поэтому они могут «слипаться» за счет водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил.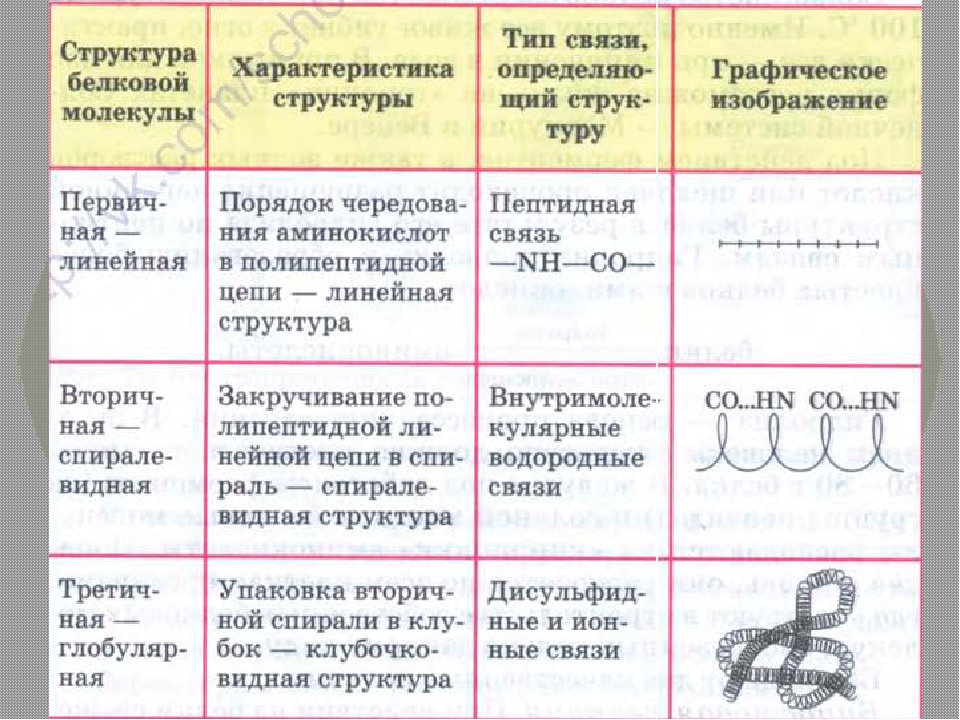 При значениях рН, отличающихся от рI, молекулы белка будут нести одинаковый заряд — либо положительный, либо отрицательный. В результате этого между молекулами будут существовать силы электростатического отталкивания, препятствующие их «слипанию», растворимость будет выше.
При значениях рН, отличающихся от рI, молекулы белка будут нести одинаковый заряд — либо положительный, либо отрицательный. В результате этого между молекулами будут существовать силы электростатического отталкивания, препятствующие их «слипанию», растворимость будет выше.
Растворимость белков
Белки бывают растворимые и нерастворимые в воде. Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и других факторов и определяется природой тех групп, которые находятся на поверхности белковой молекулы. К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (щелк, паутина). Многие другие белки растворимы в воде. Растворимость определяется наличием на их поверхности заряженных и полярных группировок (-СОО—, -NH3+, -OH и др.). Заряженные и полярные группировки белков притягивают к себе молекулы воды, и вокруг них формируется гидратная оболочка (рис. 15), существование которой обусловливает их растворимость в воде.
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (NH4)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка.
При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши.
На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
Денатурация белка
Рассмотрим хорошо нам знакомое явление. При нагревании яичного белка происходит постепенное его помутнение, и затем образуется твердый сгусток. Свернувшийся яичный белок – яичный альбумин – после охлаждения оказывается нерастворимым, в то время как до нагревания яичный белок хорошо растворялся в воде. Такие же явления происходят и при нагревании практически всех глобулярных белков. Те изменения, которые произошли при нагревании, называются денатурацией. Белки в естественном состоянии носят название нативных белков, а после денатурации — денатурированных.
При денатурации происходит нарушение нативной кон-формации белков в результате разрыва слабых связей (ион-ных, водородных, гидрофобных взаимодействий). В результате этого процесса могут разрушаться четвертичная, третичная и вторичные структуры белка. Первичная структура при этом сохраняется (рис. 17).
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство. Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
структура, функции и практическое применение – тема научной статьи по биологическим наукам читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
УДК 577.1 12
Белки системы врожденного иммунитета растений, осуществляющие транспорт липидов: структура, функции и практическое применение
Е. И. Финкина, Д. Н. Мельникова, И. В. Богданов, Т. В. Овчинникова*
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
117997, Москва, ул. Миклухо-Маклая, 16/10
*E-mail: [email protected]
Поступила в редакцию 05.08.2015
Принята к печати 18.12.2015
РЕФЕРАТ Среди множества молекулярных факторов системы врожденного иммунитета растений особый интерес представляют небольшие белки, осуществляющие транспорт липидов и обладающие широким спектром биологической активности. Эти белки называют липид-переносящими или липид-транспорти-рующими (ЛТБ). Можно выделить три основных аспекта, в контексте которых ЛТБ привлекают интерес исследователей. Первый из них — способность растительных ЛТБ связывать и переносить липиды, благодаря чему эти белки получили свое название и были объединены в один класс. Во-вторых, ЛТБ относятся к защитным белкам, являющихся факторами врожденного иммунитета растений. Кроме того, ЛТБ составляют один из наиболее клинически значимых классов растительных аллергенов. Цель настоящего обзора состоит в обобщении имеющихся данных о структуре, свойствах, функциях, механизмах действия и практическом применении ЛТБ для углубления понимания роли этих белков в физиологии растений и их значения в жизни человека.
Цель настоящего обзора состоит в обобщении имеющихся данных о структуре, свойствах, функциях, механизмах действия и практическом применении ЛТБ для углубления понимания роли этих белков в физиологии растений и их значения в жизни человека.
КЛЮЧЕВЫЕ СЛОВА аллергены, антимикробная активность, защита растений, липид-транспортирующие белки растений, перекрестная реактивность, связывание и перенос липидов.
СПИСОК СОКРАЩЕНИЙ ЛТБ — липид-транспортирующие белки; ЖК — жирные кислоты; ФХ — фосфа-тидилхолины; ФИ — фосфатидилинозиты; ФГ — фосфатидилглицерины; PRP (Pathogenesis-Related Proteins) — белки, связанные с патогенезом; AMP (Antimicrobial Peptides) — антимикробные пептиды; PAMP (Pathogen Associated Molecular Patterns) — ассоциированные с патогенами молекулярные структуры; DAMP (Damage Associated Molecular Patterns) — молекулярные структуры, ассоциированные с повреждением; ГФИ-якорь — гликозилфосфатидилинозитный якорь; АФК — активные формы кислорода; SAR (Systemic Acquired Resistance) — системная приобретенная резистентность; HR (Hypersensitive Response) — гиперчувствительный ответ; АСИТ — аллерген-специфическая иммунотерапия.
ВВЕДЕНИЕ
Липиды и их производные принимают участие в самых разнообразных процессах, включая биогенез мембран, дифференцировку клеток, межклеточную и внутриклеточную передачу сигналов, образование водоотталкивающих и термоизоляционных покровов, защищающих растение от воздействия неблагоприятных факторов окружающей среды, а также выполняют запасающую и энергетическую функции. В клетках про- и эукариот важную роль в метаболизме липидов играют белки, осуществляющие их внутри- и внеклеточный транспорт. В растениях
обнаружено несколько классов белков, обладающих способностью связывать и транспортировать липиды и их производные: ацил-КоА-связывающие белки (Acyl-CoA-Binding Proteins), гликолипид-транс-портирующие белки (Glycolipid Transfer Proteins), стерин-переносящие белки (Sterol Carrier Proteins), гомологи основного пыльцевого аллергена березы Betula verrucosa, зарегистрированного в базе данных аллергенов IUIS под аббревиатурой Bet v 1, белки, связывающие жирные кислоты (Fatty Acid Binding Proteins), пуроиндолины (Puroindolines) и липид-транспортирующие белки (Lipid Transfer Proteins).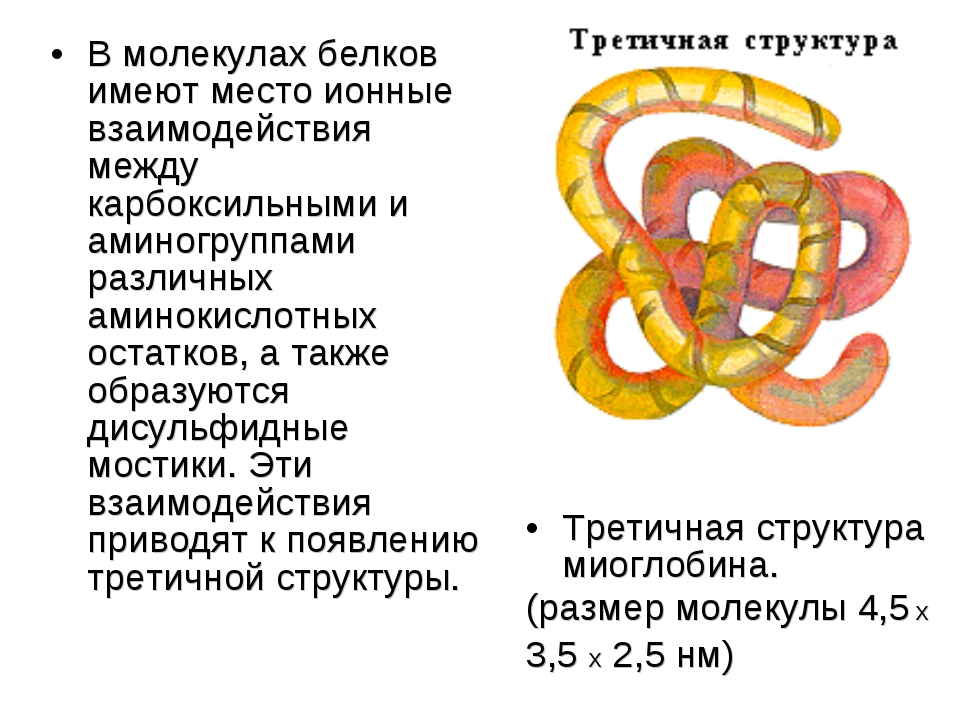 44 и Туг79 (нумерация для ЛТБ1 риса) Phe36, Tyr45 и Tyr48 (нумерация для ЛТБ2 риса)
44 и Туг79 (нумерация для ЛТБ1 риса) Phe36, Tyr45 и Tyr48 (нумерация для ЛТБ2 риса)
Сигнальный пептид, а.о. 21-27 27-35
Локализация Органы, покрытые слоем кутина (листья, стебли, цветки) Органы, покрытые слоем суберина (подземные органы)
Одна из предполагаемых функций Биосинтез кутина Биосинтез суберина
Активация иммунного ответа Элиситоры в комплексе с жасмоновой кислотой Элиситоры в комплексе со стерином
Аллергены, зарегистрированные в ШК ЛТБ1 42 растений (не считая изоаллерге-нов и вариантов) Sola l 6 томата, Api g 6 сельдерея, Ara h 16 арахиса
Сопоставление аминокислотных последовательностей белков перечисленных классов выявило отсутствие значительной структурной гомологии между ними. Эти белки имеют внутри- или внеклеточную локализацию, относительно небольшую молекулярную массу (7-30 кДа), высокое значение изоэлек-трической точки (р1 ~9-11) и компактную структуру, стабилизированную дисульфидными связями. Для пространственной структуры белков, осуществляющих транспорт липидов, характерно наличие гидрофобной впадины, внутри которой располагается сайт связывания лигандов. Эти белки обратимо связывают липиды и доставляют их к месту назначения. Белки некоторых из перечисленных классов имеют высокоспецифичные лиганды, другие белки связывают и переносят широкий спектр липидов.
К функционально наиболее значимым классам белков растений, связывающих и переносящих липи-ды, относятся ЛТБ. Эти белки были открыты в 1970 г. и первоначально названы фосфолипид-обмениваю-щими белками [1], а позднее переименованы в фос-фолипид-транспортирующие белки [2]. Дальнейшие исследования показали, что лигандами данных белков могут быть не только фосфолипиды, но и другие гидрофобные молекулы, в связи с чем ЛТБ получили
свое нынешнее название — неспецифические липид-транспортирующие белки [3]. —
—
10 20 30 40 50 60 70 80 90
CAA69949
— LTCGQVTGAIAP CLGYIATAGSVPVPLT-CCHGVaGLHHAARTTI I1RRTACHCLKQTAHAIAD — LH LH — AAAGLP AKC G- -VHIPÏKI5 PSTDCHKW———AEG79730
VLTCGOVTGALAP CLÜÍVbE SQVHVPVPLT- С CMWUGLHH AAETTLDKRTAC GCLKÜTAMAVTG -LH LH — AAAGLP ARCG— VU IPYKI £ PTT DCN KW————P27631
— -TCGdVSSAIAÍ CI fYUlAGG—PIPV£- С CHGVRS LKAAAHTTP DRQTAC HCLKQSAGSI PH — LH PH — HAVGLPRACG—VSIPYKÏSISTDCSKV————-BAH03575
P85894
-VTCGÛWGAVAP CLGYLRHGG—TPPQP-С CTGVKG LR» SSETTS DRÍ7TIС MCLKSASS SYRG -‘VS GH-YASS LP GKCG- — VWL PYKISPSTDCHEIQ————ABK96813
AI SCGäVASAI AP CI SYASGQG- -SGPÊAGC CSGVUS LBH AAETTADRRAAC MC LKKAAAGVS G — LH AO- HAAS IPSHCÖ—VSIPYTISTSTDCS KVK————P19656
Q42952 P07597 P24296
ALSCGTVSGyVAE CI GYLAQGAP -ALPRA- С CSGVTSLNH LSRTTODRa 9K®dVGSAHArET — LH SA- RAAGLP KACG- — VHIPYKIS KTT HCH SVK————ABM69132
P27056
AAA33876
P82007
AAX35807
CAB43522
QHICPKVHHIVTP CVAYGLGRA—-PI APC CRA1H DLR-FVMTRH LRKAAC KCL VGWMEH PG-LRRH PRFQ MIP EDCSUtT FVRPFWWRPRIBCGRIHLTDKLIYLDAEE Q41258
AAV40850
AAA iHt iHHt it 1 AMA
h2
h3
ш-шт-
10 20 30 40 50 60
O. 6Н) [10] риса. Звездочками отмечены остатки, составляющие конформационные эпитопы Рги р 3 (GenBank: AAV40850) [98]
6Н) [10] риса. Звездочками отмечены остатки, составляющие конформационные эпитопы Рги р 3 (GenBank: AAV40850) [98]
Б
тенциальный сайт связывания гидрофобных и амфи-фильных молекул, таких, как липиды.
ЛТБ1 состоят из 90-95 аминокислотных остатков и имеют следующий порядок образования дисульфидных связей: CLCVI, Сп-Сш, CIV-CVI1, CV-CVI11 (рис. 1А, 2А). Фрагмент -CVXCVI- в структуре ЛТБ1 содержит гидрофильную аминокислоту (чаще всего аспара-гин), боковая группа которой экспонирована на поверхности молекулы. Пространственная структура этих белков сформирована четырьмя а-спиралями, фрагментом 310-спирали и протяженным неструктурированным С-концевым участком (рис. 2А) [5, 6]. В структуре некоторых ЛТБ1, например, выделенных из кукурузы (Zea mays) и табака (Nicotiana tabacum), спирали Н1 и Н4 разделены остатками пролина на два фрагмента (Н1а и Н1Ь, Н4а и Н4Ь соответственно). Гидрофобная впадина ЛТБ1 имеет форму вытянутого туннеля, в формировании которого принимают
участие спирали Н1, Н2 и Н3, расположенные параллельно друг другу. Гидрофобный характер поверхности туннеля обусловлен боковыми радикалами таких аминокислотных остатков, как Ile, Val, Leu, Ala, но наряду с этим в формировании впадины участвуют гидрофильные остатки Arg, Lys, Ser [7]. Туннель в молекулах белков ЛТБ1 имеет два входа, различающихся по размеру. У большинства ЛТБ1 около большого входа располагается основный остаток Arg44 (нумерация относительно ЛТБ1 риса Oryza sativa), который взаимодействует с полярными головками липидов [8]. У ЛТБ1 риса в этом взаимодействии принимает участие еще один основный остаток — Lys35. Кроме остатков цистеина в молекуле большинства ЛТБ1 присутствуют консервативные остатки глицина и про-лина, обеспечивающие повороты между спиралями; два остатка тирозина, один из которых находится в N-концевой области на внешней стороне а-спирали,
А
N-ter
С-С
N49
h4
Су-СУш
С»-Сш
cV—cV
C-CV
h3
С»-Сш
CIV-C
Рис. 2. Пространственные структуры (А) ЛТБ1 (PDB Ю: 1RZL) и (Б) ЛТБ2 (PDB ID: 1L6H) из риса в ленточном представлении. Указаны номера а-спиралей (Н1-Н4). Фиолетовым цветом показаны гидрофобные остатки, красным — остатки, взаимодействующие с липидным лигандом [5, 10], желтым — дисульфидные связи, зеленым -остаток во фрагменте -СУХСУ’-, обращенный наружу или внутрь молекулы белка
2. Пространственные структуры (А) ЛТБ1 (PDB Ю: 1RZL) и (Б) ЛТБ2 (PDB ID: 1L6H) из риса в ленточном представлении. Указаны номера а-спиралей (Н1-Н4). Фиолетовым цветом показаны гидрофобные остатки, красным — остатки, взаимодействующие с липидным лигандом [5, 10], желтым — дисульфидные связи, зеленым -остаток во фрагменте -СУХСУ’-, обращенный наружу или внутрь молекулы белка
а второй расположен в С-концевой области у большого входа в гидрофобный туннель и участвует во взаимодействии с лигандами [7, 9].
ЛТБ2, состоящие из 65-70 аминокислотных остатков, изучены в меньшей степени, чем ЛТБ1. ЛТБ2 во фрагменте -CVXCVI- в качестве центрального остатка чаще всего содержат фенилаланин, обращенный внутрь молекулы, и имеют иную организацию дисульфидных связей: CI-CV, Сп-Сш, CIV-CVI1, CVI-CV111 (рис. 1Б, 2Б) [10]. Пространственная структура белков этого подкласса включает три а-спирали и область, содержащую одиночные витки спирали (рис. 2Б). В структуре ЛТБ2 спирали h2 и h3 располагаются параллельно друг другу, а спираль h4 направлена под углом 90° относительно h3. Гидрофобная впадина ЛТБ2 по форме напоминает трехгранный полый бокс с расположенными внутри боковыми радикалами остатков Ala, Ile, Leu, Phe и Val. Трехгранный бокс ЛТБ2 по объему меньше гидрофобной полости ЛТБ1, однако его более выраженная пластичность позволяет белкам этого подкласса связывать крупные лиганды с жесткой структурой, например стерины [10-12]. Боковые радикалы Phe39, Tyr45 и Tyr48 (нумерация относительно ЛТБ2 риса) повернуты внутрь полости и контактируют с ли-пидным лигандом [13]. Помимо остатков цистеина в структуре ЛТБ2 присутствуют консервативные остатки Gln, Tyr и Pro.
Объем гидрофобной впадины у ЛТБ обоих подклассов может значительно изменяться. Например, размер гидрофобной впадины у ЛТБ1 риса равен 249 А3, однако при связывании белка с пальмитиновой кислотой ее объем увеличивается до 1354 А3. ис-конфигурации [18], две из которых — линолевая и олеиновая кислоты — являются предшественниками мономеров кути-на и суберина.
ис-конфигурации [18], две из которых — линолевая и олеиновая кислоты — являются предшественниками мономеров кути-на и суберина.
ЛТБ1, в отличие от ЛТБ2, не связывают стерины. Установлено, что в зависимости от пространственной организации молекул ЛТБ1 и лиганда ориентация последнего в гидрофобной впадине может быть различной. Например, в комплексах ЛТБ1 кукурузы с 1-пальмитоиллизофосфатидилхолином [9] и ЛТБ1 пшеницы (Triticum aestivum) с димиристоилфосфа-тидилглицерином [18] лиганды размещаются в полости белка в «прямой» ориентации, т.е. полярные головки липидов расположены вблизи большого входа в гидрофобную впадину. В то же время в комплексе ЛТБ1 ячменя (Hordeum vulgare) с пальмитоил-КоА лиганд имеет «обратную» ориентацию, его алифатические цепи сильно изогнуты и полярная головка направлена в сторону меньшего входа впадины [19].
ЛТБ1 растений могут связывать одну или две молекулы лизофосфолипида [20]. Предполагается, что ЛТБ этого подкласса взаимодействуют с лиган-дами согласно кооперативной модели связывания. Если в гидрофобной полости находятся две молекулы лиганда, то их ориентация и прочность связывания с белком не одинаковы. Так, в комплексе ЛТБ1 пшеницы с лизомиристоилфосфатидилхолином две молекулы этого лиганда ориентированы в гидрофобной полости по принципу «голова к хвосту» [19, 21]. Высказывается предположение, что второй сайт связывания в ЛТБ активируется только тогда, когда первый уже занят лигандом.
Показано, что в регуляции связывания липи-дов растительными ЛТБ принимает участие каль-ций-кальмодулиновая система. Растительные ЛТБ связываются с кальмодулином вне зависимости от присутствия ионов кальция. Потенциальный сайт связывания кальмодулина с Zm-LTP кукурузы и Ace-AMP1 лука лежит в средней части полипептидной цепи ЛТБ (аминокислотные остатки
46-60) и имеет структуру, сходную с ВАА-доменом (Basic Amphiphilic a-helix) кальмодулин-связыва-ющих белков [22].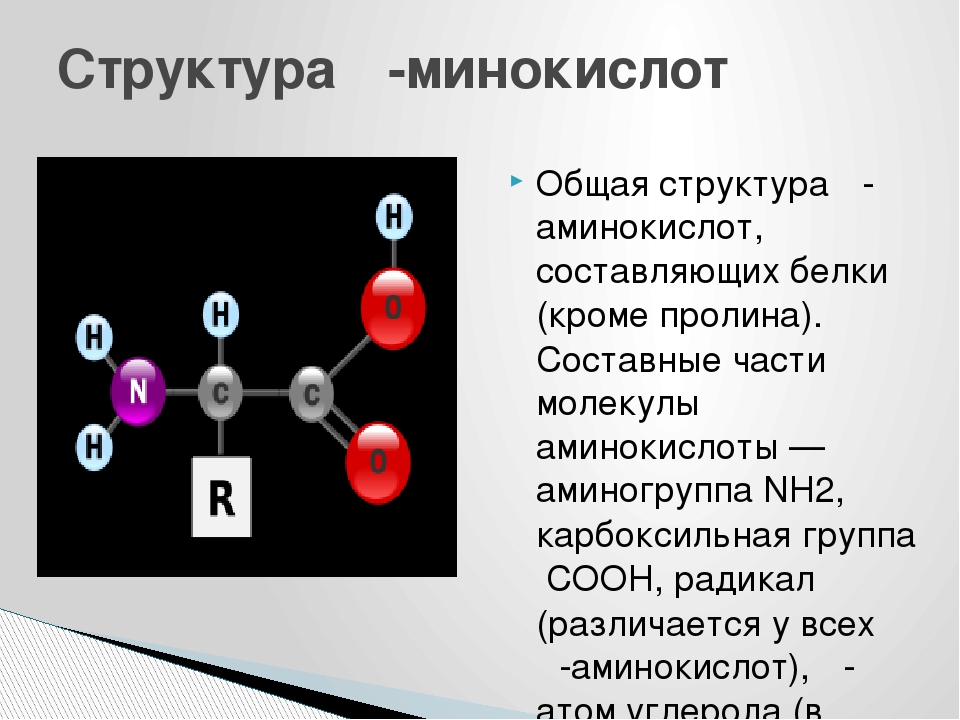 Отличительной особенностью ВАА-подобного домена у растительных ЛТБ является отсутствие Trp, имеющего решающее значение для кальций-зависимого связывания кальмодулина. В присутствии кальмодулина у Zm-LTP кукурузы снижается способность связывать липиды, что объясняется локализацией в кальмодулин-связываю-щем центре этого белка остатка Arg46, участвующего в связывании липидов. В то же время сайт связывания кальмодулина у белка репы (Brassica rapa), названного BP-10, и ЛТБ1 арабидопсиса (Ärabidopsis thaliana) находится в С-концевой области (аминокислотные остатки 69-81) и не имеет структурного сходства ни с одним из известных кальмодулин-связы-вающих центров [23]. Образование комплекса BP-10 с кальмодулином приводит к повышению эффективности связывания липидов. Причиной этого эффекта считается расположение в кальмодулин-связываю-щем центре данного ЛТБ остатка Tyr81, играющего важную роль во взаимодействии с липидным лиган-дом.
Отличительной особенностью ВАА-подобного домена у растительных ЛТБ является отсутствие Trp, имеющего решающее значение для кальций-зависимого связывания кальмодулина. В присутствии кальмодулина у Zm-LTP кукурузы снижается способность связывать липиды, что объясняется локализацией в кальмодулин-связываю-щем центре этого белка остатка Arg46, участвующего в связывании липидов. В то же время сайт связывания кальмодулина у белка репы (Brassica rapa), названного BP-10, и ЛТБ1 арабидопсиса (Ärabidopsis thaliana) находится в С-концевой области (аминокислотные остатки 69-81) и не имеет структурного сходства ни с одним из известных кальмодулин-связы-вающих центров [23]. Образование комплекса BP-10 с кальмодулином приводит к повышению эффективности связывания липидов. Причиной этого эффекта считается расположение в кальмодулин-связываю-щем центре данного ЛТБ остатка Tyr81, играющего важную роль во взаимодействии с липидным лиган-дом.
ЛТБ растений не только связывают липиды, но и осуществляют их перенос между мембранами в опытах in vitro. Они переносят фосфолипиды, например, фосфатидилхолины (ФХ), фосфатидилино-зиты (ФИ), фосфатидилглицерины (ФГ) и их производные, а также ацил-КоА [24-26]. На примере ЛТБ пшеницы показано, что липид-транспортирующая активность ЛТБ2 в несколько раз выше, чем у ЛТБ1 [27].
Механизм транспортировки липидов с участием ЛТБ до сих пор неизвестен. Предполагается, что растительные ЛТБ, так же как и фосфатидил-холин-специфичные ЛТБ млекопитающих, переносят липиды по челночному механизму. Комплекс ЛТБ-фосфолипид взаимодействует с мембраной, в результате чего происходит обмен фосфолипидами между комплексом и мембраной [3].
Прямые доказательства участия ЛТБ растений в связывании и переносе липидов in vivo до сих пор отсутствуют. Единственным комплексом ЛТБ c ли-гандом, обнаруженным в растительных клетках, является ковалентный аддукт LTP1 ячменя с окси-липином, образующийся при взаимодействии карбоксильной группы Asp7 с оксидом аллена в молекуле 9(£),10-эпокси-10,12(2)-октадекадиеновой кислоты [28, 29]. В результате реакции образуется a-кетол — 9-гидрокси-10-оксо-12(2)-октадеценовая кислота. Необходимо отметить, что образование этого ковалентного комплекса, получившего название LTP1b, приводит к увеличению пластичности гидрофобной впадины белка и его способности переносить липиды.
В результате реакции образуется a-кетол — 9-гидрокси-10-оксо-12(2)-октадеценовая кислота. Необходимо отметить, что образование этого ковалентного комплекса, получившего название LTP1b, приводит к увеличению пластичности гидрофобной впадины белка и его способности переносить липиды.
Некоторые ЛТБ способны не только связывать и переносить липиды, но и разрушать модельные мембраны. В качестве примера можно привести белок подсолнечника (Helianthus annuus), названный Ha-AP10, который разрушает липосомы, состоящие из ФХ и ФГ [30]. Интересно отметить отсутствие корреляции между липид-связывающей и ли-пид-переносящей активностью и способностью ЛТБ разрушать мембраны. Например, ЛТБ ячменя связывает широкий спектр липидов, однако слабо влияет на свойства модельных мембран [31]. Ace-AMP1 лука не связывает липиды, но нарушает целостность двухслойных везикул, состоящих из анионных ли-пидов [14].
БИОСИНТЕЗ И ЛОКАЛИЗАЦИЯ
Класс ЛТБ относится к большому семейству белков, связанных с патогенезом (Pathogenesis-Related Proteins, или PRP). Индукция синтеза данных белков происходит при воздействии на растение абиотических и биотических стрессорных факторов и лежит в основе одного из ключевых защитных механизмов, имеющихся в арсенале растений. PRP присутствуют во всех органах растений, накапливаются в вакуолях и апопласте, а также в первичной и вторичной клеточной стенке. Такая локализация согласуется с защитной функцией PRP, которые, наряду с антимикробными пептидами (AMP), создают своеобразный барьер на пути проникновения патогена [32].
Семейство белков, связанных с патогенезом, помимо ЛТБ (PRP-14), включает белки еще 16 классов: глюканазы (PRP-2), хитиназы (PRP-3,4,8), ингибиторы протеиназ (PRP-6), гомологи основного пыльцевого аллергена березы Bet v 1 (PRP-10), дефенсины (PRP-12), тионины (PRP-13) и др. [33]. Абиотическими индукторами синтеза PRP являются УФ-излучение, осмотический шок, дефицит влаги, низкие температуры, засоление почвы. Синтез PRP при инфицировании растения индуцируется как первичными, так и вторичными элиситорами — неспецифичными патоген-ассоциированными молекулярными структурами (Pathogen Associated Molecular Patterns, или PAMP), и структурами, ассоциированными с повреждением (Damage-Associated Molecular Patterns, или DAMP), а также специфичными эф-фекторными белками патогенов. Индукторами синтеза PRP являются такие фитогормоны, как этилен, ауксины, абсцизовая, жасмоновая и салициловая кислоты. На определенных стадиях онтогенеза активация синтеза и тканеспецифичная аккумуляция PRP происходят также в отсутствие факторов стресса [34].
[33]. Абиотическими индукторами синтеза PRP являются УФ-излучение, осмотический шок, дефицит влаги, низкие температуры, засоление почвы. Синтез PRP при инфицировании растения индуцируется как первичными, так и вторичными элиситорами — неспецифичными патоген-ассоциированными молекулярными структурами (Pathogen Associated Molecular Patterns, или PAMP), и структурами, ассоциированными с повреждением (Damage-Associated Molecular Patterns, или DAMP), а также специфичными эф-фекторными белками патогенов. Индукторами синтеза PRP являются такие фитогормоны, как этилен, ауксины, абсцизовая, жасмоновая и салициловая кислоты. На определенных стадиях онтогенеза активация синтеза и тканеспецифичная аккумуляция PRP происходят также в отсутствие факторов стресса [34].
ЛТБ обнаружены в различных органах растений -семенах, листьях, стеблях, корнях, цветках и плодах.
Чаще всего ЛТБ локализуются в покрытых кутикулой клетках эпидермиса, но обнаруживаются также в эмбриональных и сосудистых тканях. ЛТБ синтезируются в растительных клетках в виде пребелков, содержащих гидрофобную сигнальную последовательность (21-27 или 27-35 аминокислотных остатков у ЛТБ1 или ЛТБ2 соответственно), и являются секреторными белками с преимущественно внеклеточной локализацией [35, 36]. Некоторые ЛТБ имеют нехарактерную внутриклеточную локализацию. Так, ЛТБ из семян клещевины (Ricinus communis) обнаружен в глиоксисомах [37], ЛТБ из семян виг-ны (Vigna unguiculata) — в вакуолях [38], Ca-LTP(1) из семян перца (Capsicum annuum) — в везикулах [39]. Особый интерес представляет вопрос о том, каким образом ЛТБ, синтезируемые в виде пребелков и не имеющие соответствующих сигнальных последовательностей, попадают в эти клеточные органел-лы. Установлено, что ЛТБ подсолнечника Ha-AP10 изменяет свою локализацию. В покоящихся семенах Ha-AP10 находится в апопласте, но при набухании и прорастании семени, возможно, с помощью эндо-цитоза, поступает внутрь клеток и переходит в ор-ганеллы, участвующие в метаболизме липидов [40].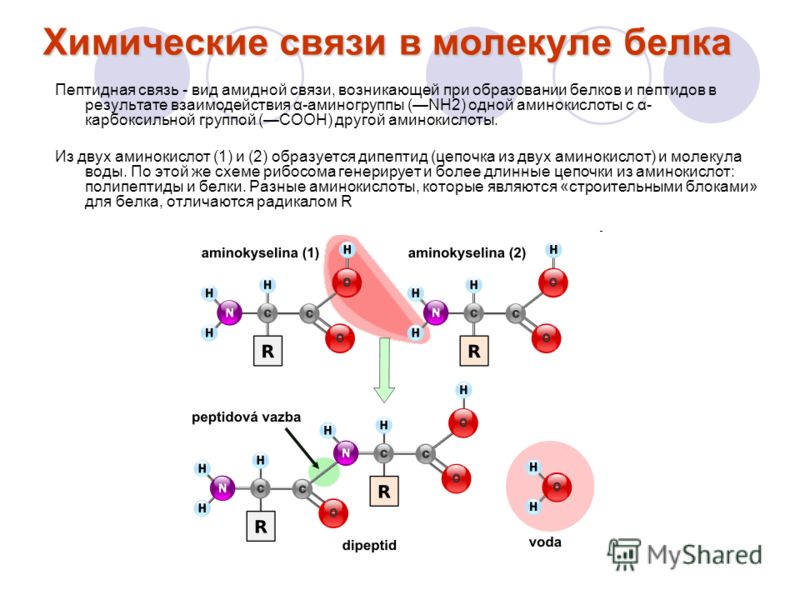
В некоторых растениях обнаружены ЛТБ, названные LTPG (GPI-anchored Lipid Transfer Proteins), которые синтезируются в виде предшественников, содержащих помимо N-концевого сигнального пептида С-концевую сигнальную последовательность. Эта последовательность обеспечивает посттрансляционное присоединение к белку гликозилфосфатиди-линозитного якоря (ГФИ), благодаря которому LTPG могут локализоваться на внешней стороне плазматической мембраны или секретироваться в апопласт после отщепления ГФИ-якоря [41]. Еще одну группу необычных ЛТБ, имеющих внеклеточную локализацию, составляют ксилоген из циннии (Zinnia elegans) и ксилоген-подобные белки других растений [42]. В структуре генов ксилоген-подобных белков, которые относятся к большому семейству арабинога-лактановых белков (АГБ), присутствует сигнальный пептид, домен ЛТБ, несколько доменов АГБ и ГФИ-якорь. В процессе созревания эти белки претерпевают ряд посттрансляционных превращений, включая удаление N-концевого сигнального пептида, присоединение ГФИ-якоря, гидроксилирование остатков пролина и О-гликозилирование [42].
ЛТБ растений кодируются мультигенными семействами и в геноме растений, как правило, представлены набором генов, кодирующих различные изоформы. Экспрессия генов различных изоформ ЛТБ отличается ярко выраженной тканевой специфичностью и происходит на определенных стадиях онтогенеза [36]. Предполагается, что это связано
с тем, что разные изоформы ЛТБ выполняют различные функции [43]. Дифференциальная экспрессия генов множественных изоформ ЛТБ происходит также при воздействии на растение различных абиотических и биотических факторов окружающей среды и может рассматриваться как один из элементов защитной стратегии в условиях стресса [44]. Дифференциальная экспрессия генов изоформ показана на примерах ЛТБ кунжута (Sesamum indicum) [45], арабидопсиса [43, 46], перца [47], клещевины [37], винограда (Vitis vinifera) [48], тамарикса жестковоло-систого (Tamarix hispida) [49] и томата (Lycopersicon pennellii) [50].
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
ЛТБ, как уже упоминалось, составляют один из классов защитных PRP, многие из которых обладают антимикробной и ферментативной активностями или являются ингибиторами ферментов. Различные представители класса ЛТБ проявляют антибактериальную, противогрибковую, противовирусную, антипролиферативную активности, обладают способностью влиять на активность разнообразных ферментов [36].
Антимикробная активность
Многие ЛТБ обладают антимикробной активностью и ингибируют рост таких фитопатогенных бактерий и грибов, как Clavibacter michiganensis, Pseudomonas solanacearum, P. syringae, Alternaria brassicola, Ascochyta pisi, Colletotrichum lindemuthianum, Fusarium solani, F. graminearum, F. culmorum, F. oxysporum, Botrytis cinerea, Sclerotinia sclerotiorum, Verticillium dahliae и др. ЛТБ из перца и кофе (Coffea canephora) активны также в отношении патогенных для человека штаммов грибков рода Candida [39, 51]. Антимикробное действие большинства растительных ЛТБ характеризуется специфичностью и проявляется в отношении определенного спектра микроорганизмов. Выраженной антимикробной активностью в микромолярных концентрациях обладают ЛТБ из лука [52], редиса (Raphanus sativus) [52] и арабидопсиса [53]. Основная же масса ЛТБ умеренно или слабо влияет на рост микроорганизмов, в некоторых случаях это влияние вообще отсутствует [54]. Антимикробная активность ЛТБ растений снижается в растворах с высокой концентрацией соли и в присутствии ионов кальция, что сближает данные белки с другими классами растительных AMP и PRP [52]. Как и растительные дефенсины, ЛТБ обладают способностью действовать в синергизме с тионинами [55], не оказывают токсического действия на растительные клетки и клетки млекопитающих, включая фибробласты и эритроциты [30, 52].
Разрушение дисульфидных связей, стабилизирующих структуру растительных ЛТБ, приводит к тому, что эти белки теряют способность ингиби-ровать рост микроорганизмов и связывать липиды [56].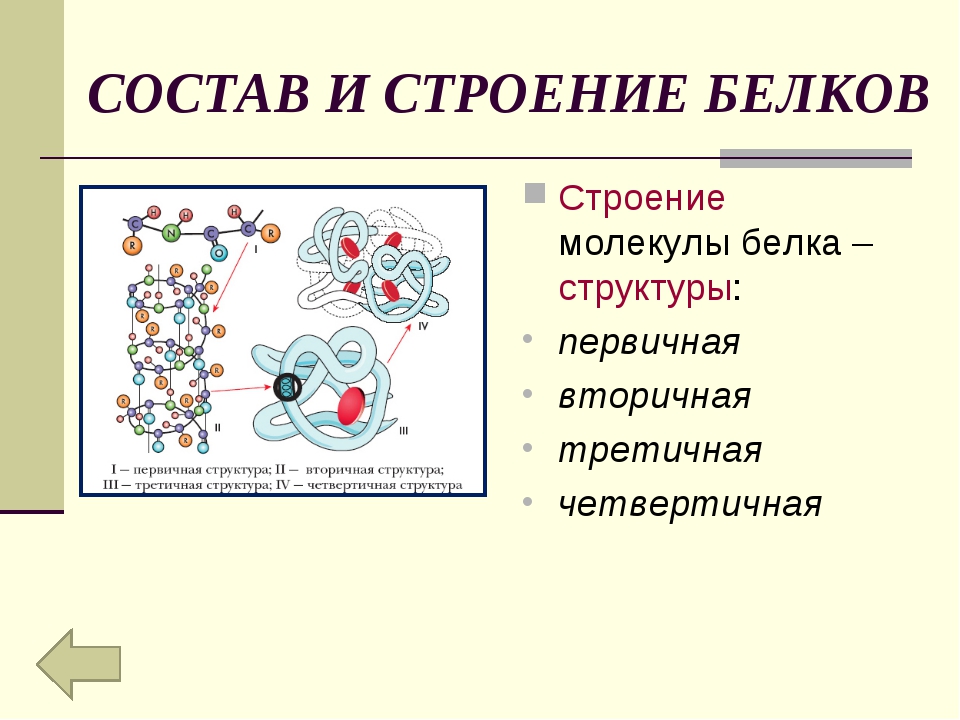 В то же время другие аминокислотные остатки, необходимые для проявления антимикробной активности, остаются неизвестными. Для LTP110 из риса показано, что для проявления антимикробной активности этого белка важны консервативные остатки Tyr17, Arg46 и Pro72, которые у большинства ЛТБ1 играют существенную роль в стабилизации структуры белка [57]. При изучении изоформ ЛТБ пшеницы показано, что отличие всего в один аминокислотный остаток (Pro3Ser в изоформах TaLt10B6 и TaLt710h34, Asn24Ser в TaLt10F9 и TaBs116G9) существенно влияет на антимикробную активность белков. Предполагается, что замена даже одного аминокислотного остатка может приводить к изменению пространственной структуры ЛТБ и влиять на распределение положительного заряда на поверхности его молекулы [56].
В то же время другие аминокислотные остатки, необходимые для проявления антимикробной активности, остаются неизвестными. Для LTP110 из риса показано, что для проявления антимикробной активности этого белка важны консервативные остатки Tyr17, Arg46 и Pro72, которые у большинства ЛТБ1 играют существенную роль в стабилизации структуры белка [57]. При изучении изоформ ЛТБ пшеницы показано, что отличие всего в один аминокислотный остаток (Pro3Ser в изоформах TaLt10B6 и TaLt710h34, Asn24Ser в TaLt10F9 и TaBs116G9) существенно влияет на антимикробную активность белков. Предполагается, что замена даже одного аминокислотного остатка может приводить к изменению пространственной структуры ЛТБ и влиять на распределение положительного заряда на поверхности его молекулы [56].
На сегодняшний день установлено, что антимикробная активность растительных ЛТБ не связана с их способностью взаимодействовать с липидами. Так, на примере восьми изоформ ЛТБ пшеницы показано отсутствие корреляции между способностью этих белков ингибировать рост патогенных микроорганизмов и связывать липиды [56]. На примере Ace-AMP1 лука [52] и мутантной изоформы ЛТБ риса [57] также показано, что белки данного класса могут обладать антимикробной активностью, но не связывать при этом молекулы липидов и наоборот.
Растительные ЛТБ оказывают не только фунги-статическое, но и фунгицидное действие и подобно другим AMP вызывают нарушение проницаемости модельных мембран [30] и цитоплазматических мембран фитопатогенных грибов [30, 56]. Так, ЛТБ лука [14], подсолнечника [30] и в меньшей степени ячменя [31] обладают способностью нарушать проницаемость липосом, состоящих только из анионных фосфоли-пидов или из смеси анионных и нейтральных фосфо-липидов, вызывая утечку из них флуоресцентного красителя. Однако стоит отметить, что этот эффект выражен гораздо слабее, чем у других AMP растений, и наблюдается только в растворах с низкой ионной силой.
Механизм антимикробного действия представителей класса ЛТБ до сих пор неизвестен. Тем не менее возможной мишенью антимикробного действия ЛТБ считается цитоплазматическая мембрана. Предполагается, что растительные ЛТБ, как и другие катионные мембранотропные AMP, связываются посредством электростатических взаимодействий с цитоплазматической мембраной фитопатогена,
вызывая ее дестабилизацию и нарушение проницаемости. Ослаблением электростатического взаимодействия с клеточной мембраной фитопатоге-на объясняется менее выраженная антимикробная активность изоформ ЛТБ, содержащих меньше основных аминокислотных остатков [56]. Считается, что возможной причиной избирательной токсичности ЛТБ растений могут быть различия в липидном составе мембран клеток бактерий, грибов, растений и млекопитающих.
Противовирусная, антипролиферативная активность
Показано, что ЛТБ нарцисса (Narcissus tazetta) и капусты полевой (Brassica campestris), называемой также сурепицей, обладают противовирусной активностью и способностью ингибировать пролиферацию опухолевых клеток человека. ЛТБ нарцисса, обозначенный как NTP, в экспериментах in vitro значительно ингибировал образование бляшек респираторного синцитиального вируса (RSV) и цитопатический эффект вируса гриппа A (h2N1), а также пролиферацию линии клеток промиелоцитарного лейкоза человека (HL-60). ЛТБ капусты полевой подавлял активность обратной транскриптазы вируса иммунодефицита человека типа 1 (HIV-1), а также пролиферацию клеток злокачественной гепатомы HepG2 и рака молочной железы MCF7. Механизм противоопухолевой активности ЛТБ пока не установлен [58, 59].
Ингибирование активности ферментов
Отдельные представители класса ЛТБ, как и ингибиторы протеаз (PRP-6), и некоторые дефенсины (PRP-12) [60, 61], обладают способностью подавлять активность протеолитических ферментов и а-амилаз. Так, обнаружено, что ЛТБ обоих подклассов из семян ячменя ингибируют активность цистеиновых эндопро-теаз [62]. Также показано, что ЛТБ1 из семян гинкго двулопастного (Ginkgo biloba) подавляет активность цистеиновой (папаин), аспартатной (пепсин) и сери-новой (трипсин) протеаз [63]. ЛТБ1 из семян кофе и перца ингибируют активность а-амилазы человека [39, 51]. Как полагают, ЛТБ, способные ингибировать активность собственных и чужеродных ферментов, могут принимать участие как в развитии и прорастании семян, так и в защите растения от насекомых и травоядных животных.
Так, обнаружено, что ЛТБ обоих подклассов из семян ячменя ингибируют активность цистеиновых эндопро-теаз [62]. Также показано, что ЛТБ1 из семян гинкго двулопастного (Ginkgo biloba) подавляет активность цистеиновой (папаин), аспартатной (пепсин) и сери-новой (трипсин) протеаз [63]. ЛТБ1 из семян кофе и перца ингибируют активность а-амилазы человека [39, 51]. Как полагают, ЛТБ, способные ингибировать активность собственных и чужеродных ферментов, могут принимать участие как в развитии и прорастании семян, так и в защите растения от насекомых и травоядных животных.
ВОЗМОЖНЫЕ ФУНКЦИИ ЛТБ
Известно, что ЛТБ играют важную роль в растениях. Выключение генов, кодирующих данные белки, приводит к нарушению вегетативного и репродуктивного развития растений, снижению их устойчивости
к инфекциям [43, 64, 65]. На основании результатов исследований по подавлению экспрессии генов ЛТБ высказан ряд предположений о возможном участии представителей данного класса белков в адаптации растений к стрессу, метаболизме липидов, эмбриогенезе, росте и размножении растений, симбиозе и других процессах. Считается, что многие из этих функций обусловлены способностью ЛТБ связывать и переносить молекулы липидов (рис. 3).
Участие в метаболизме липидов
В связи с тем, что растительные ЛТБ обладают способностью связывать и переносить молекулы липи-дов, считается, что эти белки принимают участие в целом ряде процессов, сопровождающихся изменениями липидного состава. Для ЛТБ, имеющих внеклеточную локализацию, предполагается участие в формировании защитного слоя кутикулы, мономерные компоненты которой образуются в эпи-дермальных клетках и доставляются к месту биосинтеза. Активация биосинтеза кутикулы, которая играет важную роль в поддержании водного баланса и защите растений от проникновения патогенов, происходит в условиях действия разнообразных стрес-сорных факторов и является одним из защитных механизмов растений. Прямых доказательств причастности ЛТБ к этому процессу пока не найдено, однако показано, что растительные ЛТБ присутствуют в высоких концентрациях в эпидермальных тканях и способны связывать жирные кислоты, необходимые для синтеза кутина и суберина. Кроме того, индукция синтеза ЛТБ сопровождается утолщением слоя кутикулы [66], а выключение генов ЛТБ приводит к изменению липидного состава и плотности кутикулярного слоя [67]. Предложено два возможных механизма доставки компонентов кутикулы с участием ЛТБ. В соответствии с первым из них ЛТБ поступают в клетку посредством рецептор-опосредованного эндоцитоза, осуществляемого при слиянии везикул, содержащих ЛТБ и мономеры кутина. Второй механизм предполагает функционирование ЛТБ между плазматической мембраной и клеточной стенкой растения и существование молекулы-переносчика, действующего с внутренней стороны плазматической мембраны [68]. Интересен тот факт, что ЛТБ1 присутствуют в органах, покрытых слоем кутина (листья, стебли, цветки), в то время как ЛТБ2 обнаруживаются в покрытых суберином подземных органах. Это свидетельствует в пользу дифференциального участия белков первого и второго подклассов в формировании кутинового и суберинового слоев [35]. Показано также, что LTPG, имеющие ГФИ-якорь, возможно, принимают участие в биосинтезе и накоплении суберина [41].
Прямых доказательств причастности ЛТБ к этому процессу пока не найдено, однако показано, что растительные ЛТБ присутствуют в высоких концентрациях в эпидермальных тканях и способны связывать жирные кислоты, необходимые для синтеза кутина и суберина. Кроме того, индукция синтеза ЛТБ сопровождается утолщением слоя кутикулы [66], а выключение генов ЛТБ приводит к изменению липидного состава и плотности кутикулярного слоя [67]. Предложено два возможных механизма доставки компонентов кутикулы с участием ЛТБ. В соответствии с первым из них ЛТБ поступают в клетку посредством рецептор-опосредованного эндоцитоза, осуществляемого при слиянии везикул, содержащих ЛТБ и мономеры кутина. Второй механизм предполагает функционирование ЛТБ между плазматической мембраной и клеточной стенкой растения и существование молекулы-переносчика, действующего с внутренней стороны плазматической мембраны [68]. Интересен тот факт, что ЛТБ1 присутствуют в органах, покрытых слоем кутина (листья, стебли, цветки), в то время как ЛТБ2 обнаруживаются в покрытых суберином подземных органах. Это свидетельствует в пользу дифференциального участия белков первого и второго подклассов в формировании кутинового и суберинового слоев [35]. Показано также, что LTPG, имеющие ГФИ-якорь, возможно, принимают участие в биосинтезе и накоплении суберина [41].
апопласт
антимикробное действие
ингибирование
активности экзоферментов
размягчение и созревание плодов
цитоплазматическая мембрана
оплодотворение цветковых растений
секреция липидов
формирование кутикулы
межклеточные взаимодействия
активация защитных механизмов в растении
внутриклеточный транспорт липидов
регуляция сигнальных путей
апоптоз
цитоплазма
липидная молекула
Рис. КК как в свободной форме, так и в виде ацил-КоА. Этот белок увеличивает также активность ацил-КоА-ок-сидазы, которая участвует в реакции Р-окисления ЖК [37]. Предполагается, что ЛТБ подсолнечника Ha-AP10, поступающий в клетки при прорастании семян, переносит в глиоксисомы ЖК, высвободившиеся при расщеплении триацилглицеринов, для их дальнейшего Р-окисления [40].
КК как в свободной форме, так и в виде ацил-КоА. Этот белок увеличивает также активность ацил-КоА-ок-сидазы, которая участвует в реакции Р-окисления ЖК [37]. Предполагается, что ЛТБ подсолнечника Ha-AP10, поступающий в клетки при прорастании семян, переносит в глиоксисомы ЖК, высвободившиеся при расщеплении триацилглицеринов, для их дальнейшего Р-окисления [40].
Показано, что индукция экспрессии генов, кодирующих ЛТБ моркови (Daucus carota), наблюдается на ранних стадиях эмбриогенеза, когда происходит разрушение одних и биосинтез других липидов, а также формирование защитного липидного слоя вокруг зародыша [69]. Роль этого белка в процессе эмбриогенеза предположительно заключается в уча-
стии в этих процессах посредством переноса соответствующих липидных молекул.
Участие в оплодотворении цветковых растений
Считается, что растительные ЛТБ играют важную роль в репродукции цветковых растений. Так, ЛТБ1 лилии (Lilium longiflorum) является компонентом, необходимым для адгезии пыльцы, формирования и роста пыльцевой трубки [70]. Предполагается, что ЛТБ1 может действовать непосредственно как адгезивный компонент либо как переносчик гидрофобного адгезивного компонента. Показано также, что одна из изоформ липид-транспортирующего белка арабидопсиса, LTP5, участвует в росте пыльцевой трубки и формировании семян [64].
Выявлена роль ЛТБ риса OsC6 в постмейотиче-ском развитии пыльцы. Установлено, что данный белок присутствует в тканях пыльника и обладает способностью связывать ЖК. Полагают, что OsC6 участвует в формировании липидных орбикул
и пыльцевой экзины, осуществляя перенос необходимых липидов из клеток тапетума к микроспорам [65].
Участие в защите и адаптации растений в условиях стресса
Утверждение, что ЛТБ участвуют в защите и адаптации растений к воздействию стрессорных факторов, основано, в основном, на повышении уровня синтеза этих белков.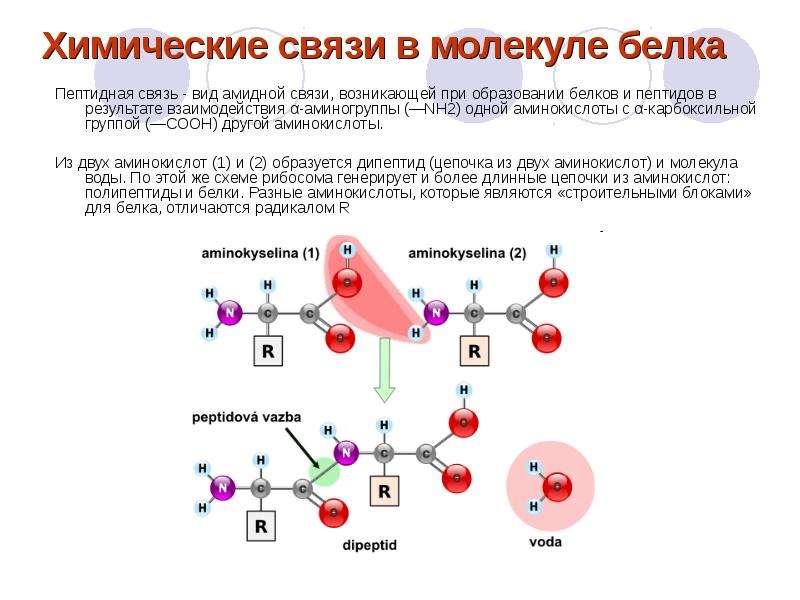 Так, синтез ЛТБ, как и других PRP, индуцируется при механическом повреждении, дефиците влаги, низких температурах, засолении почвы, инфицировании, а также при обработке растения химическими агентами [43, 45, 47, 50, 71, 72]. Индукция экспрессии генов ЛТБ в условиях стресса, возможно, связана с наличием в их промоторной области регуляторных элементов, характерных также для генов других PRP. В регуляции экспрессии генов ЛТБ участвуют такие фитогормоны, как абсцизовая и салициловая кислоты, этилен и метилжасмонат [36].
Так, синтез ЛТБ, как и других PRP, индуцируется при механическом повреждении, дефиците влаги, низких температурах, засолении почвы, инфицировании, а также при обработке растения химическими агентами [43, 45, 47, 50, 71, 72]. Индукция экспрессии генов ЛТБ в условиях стресса, возможно, связана с наличием в их промоторной области регуляторных элементов, характерных также для генов других PRP. В регуляции экспрессии генов ЛТБ участвуют такие фитогормоны, как абсцизовая и салициловая кислоты, этилен и метилжасмонат [36].
Считается, что одной из возможных причин индукции экспрессии генов ЛТБ в условиях стресса является вовлеченность этих белков в биосинтез ку-тикулярного слоя [50]. Защитная функция ЛТБ в растениях обусловлена их антимикробной активностью, криопротекторным действием и свойствами ингибиторов экзогенных ферментов, а также возможным участием в секреции других компонентов иммунной системы растений.
Железистые волоски (трихомы) растений вырабатывают эфирные масла, которые принимают участие в обмене веществ, защищают растение от вредителей, оказывают ранозаживляющее действие, служат для привлечения насекомых и предохраняют от перегревания. Обнаружено, что NtLTP1 табака (N. tabacum) специфически экспрессируется в длинных железистых волосках и участвует в секреции из головок трихом компонентов эфирных масел (дитерпе-нов, алифатических углеводородов и ароматических кислот), которые являются защитными факторами растений [73]. Транскрипты генов ЛТБ обнаружены в железистых волосках и других растений, например, мяты (Mentha piperita), люцерны (Medicago sativa), полыни (Artemisia annua), хмеля (Humulus lupulus), шалфея (Salvia fruticosa) и томата [73].
Известно, что устойчивость растений к холоду связана со стабилизацией клеточных мембран и предотвращением снижения растворимости белков при понижении температуры. В листьях акклиматизированной к холоду капусты (Brassica oleracea) обнаружены белки класса WAX9, имеющие высокую степень гомологии аминокислотных последовательностей с ЛТБ. Данные белки не обладают способностью связывать липиды, но подобно ß-1,3-
В листьях акклиматизированной к холоду капусты (Brassica oleracea) обнаружены белки класса WAX9, имеющие высокую степень гомологии аминокислотных последовательностей с ЛТБ. Данные белки не обладают способностью связывать липиды, но подобно ß-1,3-
глюканазам, осмотинам и лектинам, способны в условиях холода стабилизировать мембраны тилакоидов [72]. Предполагается, что механизм криопротектор-ного действия этих белков связан с уменьшением подвижности мембранных липидов и проницаемости бислоя при взаимодействии ЛТБ с мембраной тила-коидов [74].
Участие в активации и регуляции сигнальных каскадов
Предполагается, что ЛТБ, образуя комплексы с различными молекулами липидов, могут принимать участие в активации и регуляции различных сигнальных каскадов в растениях. Одним из классов сигнальных медиаторов растений являются оксилипины, которые образуются из ненасыщенных ЖК под действием активных форм кислорода (АФК) или ферментов и участвуют в регуляции роста и развития растения, а также в запуске ответных защитных реакций в условиях стресса. Помимо этого, оксилипины регулируют процессы обезвреживания токсичных компонентов, образующихся во время стресса. Как уже упоминалось, ЛТБ1 ячменя в процессе прорастания семян формирует ковалентные комплексы с оксили-пином — 9(£),10-эпокси-10,12(2)-октадекадиеновой кислотой, содержащей нестабильный алленоксид, образующийся в результате последовательного действия липоксигеназы и алленоксидсинтазы [28, 29]. Такое взаимодействие может свидетельствовать о совместном участии ЛТБ и оксилипинов в регуляции сигнальных путей, запускающих механизм предотвращения повреждения клеток растения в условиях стресса [29].
ЛТБ в комплексе с молекулами липидов действуют как эндогенные элиситоры, взаимодействующие со специфическими рецепторами на цитоплазма-тической мембране растительных клеток и обеспечивающие развитие иммунного ответа в условиях инфицирования (рис. 4). Так, показано, что ЛТБ риса и табака обладают способностью взаимодействовать с элиситиновыми рецепторами [21, 75, 76]. Элиситины — хорошо изученные РАМР растений, которые имеют молекулярную массу около 10 кДа и продуцируются фитопатогенными оомице-тами (Phytophthora и РуШшт), паразитирующими на высших растениях. Данные белки, благодаря наличию в их структуре гидрофобной впадины, обладают способностью связывать стерины и обеспечивают фитопатогенные микроорганизмы необходимыми для их жизнедеятельности липидами, источником которых служат растения. Все элиситины имеют а-спиральную структуру, стабилизированную тремя дисульфидными связями, и в комплексе со стерином распознаются растением посредством
4). Так, показано, что ЛТБ риса и табака обладают способностью взаимодействовать с элиситиновыми рецепторами [21, 75, 76]. Элиситины — хорошо изученные РАМР растений, которые имеют молекулярную массу около 10 кДа и продуцируются фитопатогенными оомице-тами (Phytophthora и РуШшт), паразитирующими на высших растениях. Данные белки, благодаря наличию в их структуре гидрофобной впадины, обладают способностью связывать стерины и обеспечивают фитопатогенные микроорганизмы необходимыми для их жизнедеятельности липидами, источником которых служат растения. Все элиситины имеют а-спиральную структуру, стабилизированную тремя дисульфидными связями, и в комплексе со стерином распознаются растением посредством
клеточная стенка
апопласт
мембрана
цитоплазма
киназный каскад
I
стерины, ЖК, жасмоновая кислота
изменение экспрессии генов
i
SAR
I
ЛТБ
липазы,кутиназы фитопатогенов
Рис. 4. Возможный механизм участия ЛТБ в активации иммунного ответа в растениях. ЛТБ секретируются в апопласт и связываются с молекулами липидов, которые так же секретируются растением, как, например, жасмоновая кислота, или образуются в результате действия ферментов, выделяемых фитопатогенными микроорганизмами. В комплексе с липидами ЛТБ взаимодействуют с расположенными на цитоплазматической мембране рецепторами, например, с рецептор-подобными серин-треониновыми протеинкиназами, которые содержат внеклеточный обогащенный лейциновыми повторами LRR-домен, а также трансмембранный и цитоплазмати-ческий протеинкиназный (PK) домены. Результатом этого взаимодействия может быть передача сигнала, опосредованная универсальными вторичными мессенджерами и каскадом митоген-активируемых протеинкиназ, активация ряда транскрипционных факторов, индукция синтеза защитных факторов, в том числе AMP и PRP (возможно также и изоформ ЛТБ с выраженной антимикробной активностью), и, в конечном итоге, развитие SAR
Результатом этого взаимодействия может быть передача сигнала, опосредованная универсальными вторичными мессенджерами и каскадом митоген-активируемых протеинкиназ, активация ряда транскрипционных факторов, индукция синтеза защитных факторов, в том числе AMP и PRP (возможно также и изоформ ЛТБ с выраженной антимикробной активностью), и, в конечном итоге, развитие SAR
рецептор-подобных киназ, расположенных на цитоплазматической мембране. В результате распознавания происходит активация в растениях защитных механизмов, таких, как образование фитоалексинов и АФК, развитие гиперчувствительного ответа (HR) и системной приобретенной резистентности (SAR) [77, 78]. Аминокислотные последовательности ЛТБ и элиситинов имеют низкую степень гомологии, тогда как пространственные структуры этих белков обладают выраженным сходством [79]. Растительные ЛТБ в комплексе с молекулой липида выступают в роли агонистов элиситинов и DAMP, связываются с рецепторами элиситинов и вызывают развитие иммунного ответа. Интересным фактом, говорящим о возможности существования различных путей ак-
тивации защитного ответа в растениях с участием представителей двух подклассов ЛТБ, является отличие в структуре гидрофобного лиганда, в роли которого для ЛТБ2 выступают молекулы стеринов [75], а для обладающих менее гибкой гидрофобной впадиной ЛТБ1 — жасмоновая кислота [21, 76].
Показано также, что необычный представитель ЛТБ2 из арабидопсиса, имеющий изоэлектрическую точку в кислой области pH и названный DIR1, играет ключевую роль в развитии SAR [80]. Предполагается, что данный белок в процессе инфицирования растения связывается с молекулами липидов (оксили-пинами, жирными кислотами или моноацильными фосфолипидами), которые образуются в результате работы секретируемых патогеном липаз, после чего
образованный комплекс взаимодействует с гипотетическим рецептором, запуская сигнальный каскад, приводящий к развитию SAR [81].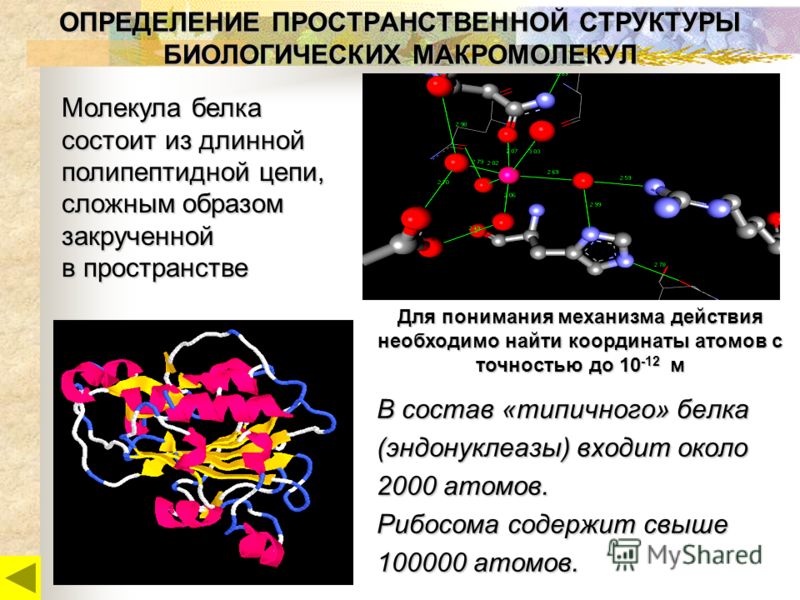
Установлено, что ксилоген из циннии, содержащий ГФИ-якорь и связывающий растительные стерины, стимулирует превращение недифференцированных клеток в элементы трахеи и, возможно, участвует в межклеточных взаимодействиях и передаче сигнала. Предполагается, что ксилогено-подобные белки других растений, ЛТБ-домены которых имеют большее сходство с ЛТБ2, также могут участвовать в межклеточных взаимодействиях и передаче сигнала, функционируя в комплексе с липидной молекулой [42].
Участие в апоптозе
Предположение о возможном участии ЛТБ в апоп-тозе выдвинуто на основании сходства между ЛТБ кукурузы и проапоптотическим белком Bid млекопитающих, который тоже имеет в своей структуре внутреннюю впадину, связывает и переносит липиды [82]. Bid находится в цитозоле и в присутствии лизо-фосфолипидов, образующихся в процессе программируемой клеточной смерти, действует на митохондрии, вызывая высвобождение факторов индукции апоптоза, в том числе цитохрома с. ЛТБ кукурузы в присутствии лизофосфолипидов также вызывает высвобождение цитохрома с из митохондрий. В качестве возможного механизма дестабилизирующего действия обоих белков рассматривают перенос лизо-фосфолипидов на наружную мембрану митохондрий, которые изменяют ее свойства, облегчая тем самым действие других проапоптотических белков [83].
Участие в симбиозе
Известно, что симбиотические ризобактерии стимулируют рост растений и защищают их от почвенных фитопатогенов, вызывая развитие так называемой индуцированной системной резистентности, которая фенотипически и функционально сходна с SAR [84]. Показано, что ЛТБ MtN5 люцерны играет важную роль в развитии симбиотических отношений между растением и клубеньковыми бактериями, а именно, вовлечен в процессы проникновения бактерий в ткани корня и формирования клубеньков [85]. абилизированная дисульфидными связями структура этих белков придает им повышенную устойчивость к расщеплению пищеварительными ферментами, позволяет достигать кишечника человека в нативной иммуногенной форме и вызывать сенсибилизацию организма [88]. Аллергизирующая способность ЛTБ в различных прошедших обработку пищевых продуктах (соках, джемах, пиве, вине и др.) объясняется их высокостабильной структурой, практически не подверженной тепловой денатурации, химической деградации и ферментативному расщеплению [89]. Необходимо отметить, что охарактеризованными аллергенами являются в основном представители первого подкласса растительных ЛTБ. Tак, в настоящий момент в базе данных аллергенов IUIS зарегистрированы всего три ЛTБ2 (из томата, арахиса и сельдерея) и 42 ЛTБ1 из различных растений, не считая их изоформ. Высокая структурная гомология ЛTБ1 обуславливает развитие перекрестных аллергических реакций.
абилизированная дисульфидными связями структура этих белков придает им повышенную устойчивость к расщеплению пищеварительными ферментами, позволяет достигать кишечника человека в нативной иммуногенной форме и вызывать сенсибилизацию организма [88]. Аллергизирующая способность ЛTБ в различных прошедших обработку пищевых продуктах (соках, джемах, пиве, вине и др.) объясняется их высокостабильной структурой, практически не подверженной тепловой денатурации, химической деградации и ферментативному расщеплению [89]. Необходимо отметить, что охарактеризованными аллергенами являются в основном представители первого подкласса растительных ЛTБ. Tак, в настоящий момент в базе данных аллергенов IUIS зарегистрированы всего три ЛTБ2 (из томата, арахиса и сельдерея) и 42 ЛTБ1 из различных растений, не считая их изоформ. Высокая структурная гомология ЛTБ1 обуславливает развитие перекрестных аллергических реакций.
ЛTБ1, широко распространенные в царстве растений, являются основными аллергенами, выделенными из фруктов и ягод, — Pru p 3 персика (Prunus persica), Pru av 3 вишни (P. avium), Mal d 3 яблока (Malus domestica), Pru d 3 сливы (P. domestica), Cit s 3 апельсина (Citrus sinensis), Vit v 1 винограда, Fra a 3 клубники (Fragaria ananassa), орехов — Cor a 8 фундука (Corylus avellana), Jug r 3 грецкого ореха (Juglans regia), Ara h 9 арахиса (Arachis hypogaea), Cas s 8 каштана (Castanea sativa), овощей — Aspa o 1 салата-латука (Asparagus officinalis), Lec s 1 спаржи (Lactuca sativa), Bra o 3 капусты, Lyc e 3 томата (Lycopersicon esculentum), Api g 2 сельдерея (Apium graveolens), злаковых — Zea m 14 кукурузы, Ory s 14 риса, Tri a 14 пшеницы, Hor v 14 ячменя и бобовых культур Len c 3 чечевицы, Pha v 3 фасоли [90-92]. Важно отметить, что ЛTБ накапливаются в основном в кожице плодов, а не в их мякоти [93], что может быть причиной развития анафилактических реакций при кожном контакте человека с плодами [94]. Cущественный вклад в первичную сенсибилизацию вносят и пыльцевые аллергены класса ЛTБ (Par j 2 постенницы иудейской (Parietaria judaica), Ole e 7 оливкового дерева (Olea europoea), Pla a 3 платана (Platanus acerifolia), Art v 3 полыни (Artimisia vulgar-is) и др. 44 [100]. В роли Т-клеточного эпитопа Рги р 3 выступает участок полипептидной цепи, соответствующий аминокислотным остаткам 61-80 [101]. Также показано, что развитие Т-клеточного ответа на Рги р 3 сопровождается увеличением экспрессии интегрина а4Р7, обеспечивающего миграцию лимфоцитов в стенку кишечника, где происходит их первичная активация [102].
44 [100]. В роли Т-клеточного эпитопа Рги р 3 выступает участок полипептидной цепи, соответствующий аминокислотным остаткам 61-80 [101]. Также показано, что развитие Т-клеточного ответа на Рги р 3 сопровождается увеличением экспрессии интегрина а4Р7, обеспечивающего миграцию лимфоцитов в стенку кишечника, где происходит их первичная активация [102].
ЭВОЛЮЦИЯ ГЕНОВ
Гены ЛТБ повсеместно присутствуют в геномах высших растений — от наиболее примитивных мохообразных до сосудистых, включая папоротникообразные, плауновидные, покрытосеменные и голосеменные, но не обнаружены в таких низших растениях, как водоросли. В связи с этим высказывается предположение о том, что ЛТБ, принимающие участие в защите растений от воздействия разнообразных стрессорных факторов окружающей среды, могли появиться в период выхода растений на сушу, т.е. около 400 млн лет тому назад [103].
Как упоминалось выше, ЛТБ одного растения кодируются обычно десятками родственных генов, образующих мультигенное семейство. Считается, что появление в процессе эволюции множественных изоформ ЛТБ, выполняющих различные функции в растениях, связано с рядом последовательных дупликаций гена-предшественника и последующих мутаций [104]. Известно, что большинство покрытосеменных подверглись в процессе эволюции одному или нескольким удвоениям целого генома. Филогенетический анализ множественных изоформ ЛТБ риса, арабидопсиса и пшеницы свидетельствует о том, что процесс дупликации генов и фрагментов
хромосом продолжается и в настоящее время [105]. Мутации в дуплицированных генах ЛТБ в процессе эволюции могли приводить к псевдогенизации гена, субфункционализации с сохранением части функций гена-предшественника или неофункционализации, т.е. приобретению геном совершенно новых функций [106]. Последние два варианта могли привести к появлению новых изоформ ЛТБ, обладающих иным спектром и степенью выраженности биологической активности, а также ЛТБ-подобных белков, значительно отличающихся от представителей класса ЛТБ по структуре и выполняющих другие функции.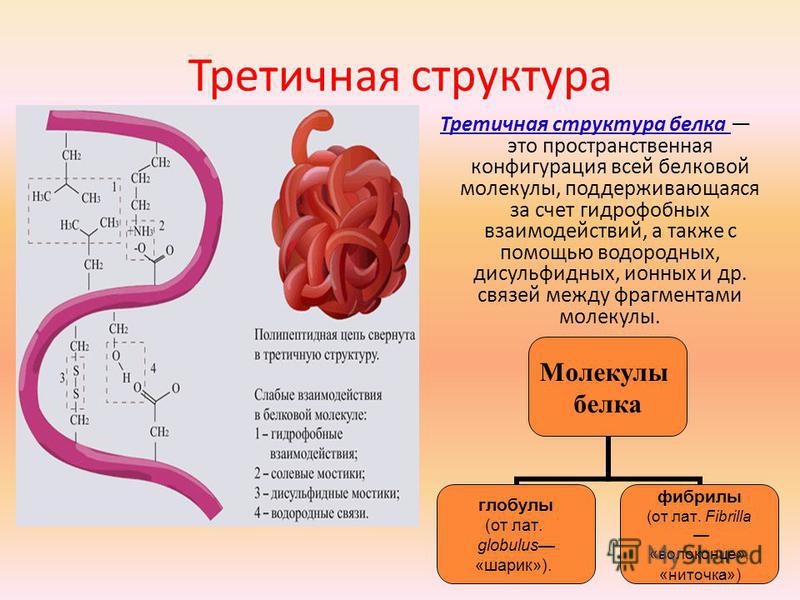
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
ЛТБ как переносчики лекарственных средств
Способность ЛТБ связывать и переносить липиды создает предпосылки для их возможного применения в качестве лиганд-связывающих белков для создания систем доставки лекарственных и косметических средств с целью защиты от преждевременной биодеградации или снижения побочных эффектов при системном применении. Возможность создания систем доставки на основе ЛТБ определяется рядом их свойств: а) устойчивостью к тепловой денатурации и действию протеаз; б) гидрофильной поверхностью, обеспечивающей биосовместимость комплекса с лигандом и снижение риска развития побочных реакций; в) защитой лекарственного вещества, расположенного внутри гидрофобной полости ЛТБ, от преждевременной биодеградации; г) небольшим размером комплекса с лигадом, обеспечивающим его эффективное проникновение в ткани; д) увеличением аффинности и специфичности при образовании комплексов ЛТБ с лигандами, которое может быть достигнуто посредством модификации аминокислотной последовательности белка.
В ряде работ показано, что растительные ЛТБ образуют комплексы не только с ЖК и фосфолипида-ми, но и с другими гидрофобными и амфифильны-ми лигандами, включая некоторые лекарственные вещества. Так, ЛТБ1 пшеницы образует комплексы с простагландином В2 (PGB2). Установлено, что при взаимодействии с ЛТБ1 PGB2 полностью погружается в гидрофобную полость белка, оказываясь при этом изолированным от окружающей среды [17]. Показано, что ЛТБ1 пшеницы связывает некоторые компоненты липидного слоя кожи (сфин-гозины, сфингомиелины и цереброзиды), которые входят в состав косметических средств. Таким образом, ЛТБ1 пшеницы может быть использован в косметологии как средство доставки эпидермальных липидов. С другой стороны, ЛТБ1 пшеницы способен связывать лекарственные средства, которые актив-
ны в отношении возбудителей лейшманиоза и HIV-1, а также обладают антинеопластическими свойствами, но имеют серьезные побочные эффекты при системном применении (например, эделфозин, илмо-фозин и их аналоги).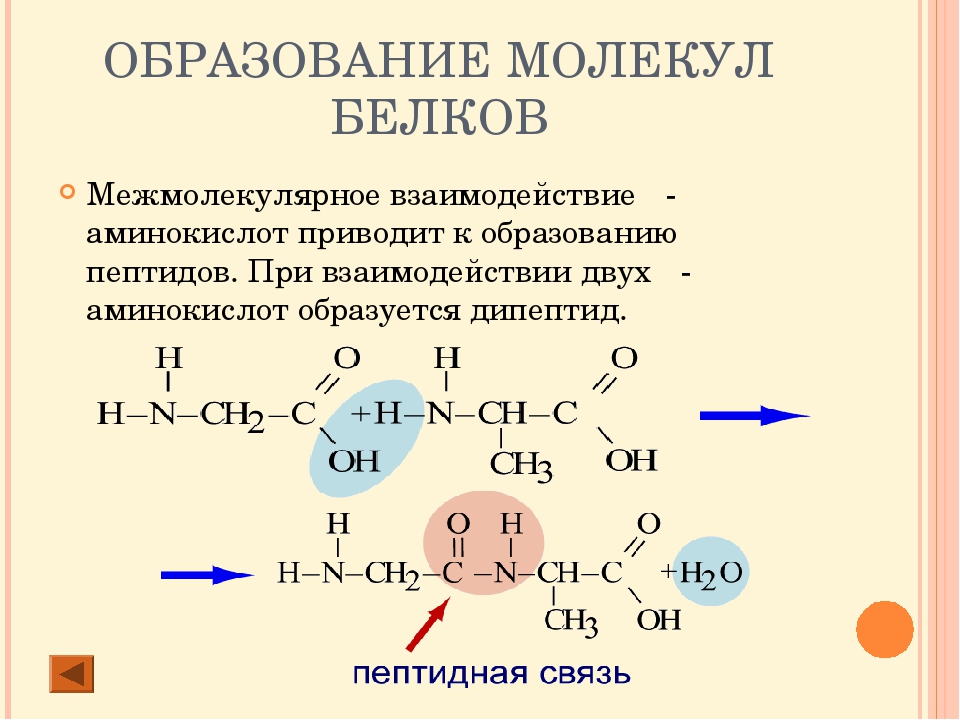 Использование ЛТБ1 пшеницы в качестве средства доставки может значительно снизить токсичность этих препаратов. Кроме того, ЛТБ1 пшеницы способен осуществлять доставку таких противогрибковых средств, как коназол BD56 и амфотерицин В [16]. Следует отметить, что белок связывает все перечисленные соединения с низкой аффинностью, что является обязательным условием транспорта и контролируемого высвобождения лиганда.
Использование ЛТБ1 пшеницы в качестве средства доставки может значительно снизить токсичность этих препаратов. Кроме того, ЛТБ1 пшеницы способен осуществлять доставку таких противогрибковых средств, как коназол BD56 и амфотерицин В [16]. Следует отметить, что белок связывает все перечисленные соединения с низкой аффинностью, что является обязательным условием транспорта и контролируемого высвобождения лиганда.
В результате скрининга с использованием библиотеки CMC (Comprehensive Medicinal Chemistry), содержащей информацию о ~7300 биологически активных соединениях, показано, что ЛТБ1 кукурузы и ЛТБ2 риса содержат не один, а два потенциальных центра связывания лекарственных веществ — один в гидрофобной полости, второй — на гидрофильной поверхности молекулы белка. У ЛТБ2 риса вблизи гидрофобной полости располагается центр связывания стеринов, например Р-ситостерина или холестерина, а на поверхности белка вблизи С-концевого участка находится область связывания трифенилме-тановых производных, например дифенил(пиридил-4)-метана [15].
ЛТБ в пищевой промышленности
Поверхностно-активные свойства ЛТБ растений делают возможным их применение в пищевой промышленности в качестве стабилизаторов пен и эмульсий. Пивоварение — одна из отраслей пищевой промышленности, где широко используются эти свойства ЛТБ. Известно, что образование и стабильность пены являются важными показателями качества пива. В многочисленных работах показано, что ЛТБ являются основными белковыми компонентами ячменного пива и играют ключевую роль в формировании и стабилизации пивной пены [35, 75]. В число основных белковых компонентов пива входит LTP1 ячменя, который связывает липиды и тем самым снижает их негативное влияние на формирование и стабильность пены. В процессе пивоварения происходит гликозилиро-вание и ацилирование LTP1, что увеличивает ам-фифильность и поверхностно-активные свойства этого белка [75]. При ферментации происходит образование LTPlb — ковалентного комплекса этого белка с 9(£),10-эпокси-10,12(2)-октадекадиеновой кислотой, о котором упоминалось выше [107]. LTP1 и LTPlb устойчивы к действию высоких температур, и в процессе нагревания при пастеризации
При ферментации происходит образование LTPlb — ковалентного комплекса этого белка с 9(£),10-эпокси-10,12(2)-октадекадиеновой кислотой, о котором упоминалось выше [107]. LTP1 и LTPlb устойчивы к действию высоких температур, и в процессе нагревания при пастеризации
пива сохраняют свою структуру и способность взаимодействовать с липидами. Необходимо отметить, что LTP1, в отличие от LTP1b, обладает противогрибковой активностью, ингибирует рост дрожжей и тем самым может негативно влиять на процесс ферментации, поэтому образование LTP1b и установление равновесия между содержанием в пиве свободной и связанной с липидом форм LTP1 важны для получения ячменного пива высокого качества.
Создание жизнестойких трансгенных растений
Большой интерес представляет возможность использования ЛTБ для создания трансгенных растений, устойчивых к действию разнообразных абиотических и биотических стрессорных факторов. Tрансгенные растения, несущие гены ЛTБ, обладают повышенной устойчивостью к фитопатогенным микроорганизмам [108], поражению вредителями [73], действию высоких температур [109], засолению почвы [108], засухе [110] и др.
ЛТБ в аллергологии
Еще одно перспективное направление применения природных и рекомбинантных ЛTБ растений — создание на их основе современных тест-систем для компонентной аллергодиагностики и вакцин, предназначенных для превентивной аллерген-специфической иммунотерапии (АCИT).
К основным способам диагностики аллергии относятся кожные аллергопробы, провокационные и эли-минационные тесты, а также иммуноферментный или иммунофлуоресцентный анализ, направленный на оценку общего уровня и выявление специфических антител классов IgE и IgG. При проведении аллергодиагностики традиционно используются неочищенные экстракты аллергенов, дающие плохо воспроизводимые, а иногда ложные результаты из-за отсутствия реальной возможности их стандартизации, а также колебаний содержания в них аллергенных белков и небелковых компонентов. временное направление развития аллергодиаг-ностики основано на замене суммарных экстрактов на индивидуальные белковые аллергокомпоненты, которые могут быть использованы для составления молекулярного профиля чувствительности пациента и изучения перекрестной реактивности аллергенов [111]. В современных тест-системах в формате микрочипов, предназначенных для компонент-разрешающей диагностики, на сегодняшний день уже используются несколько природных и рекомбинант-ных пыльцевых (Art v 3 полыни, Pla a 3 платана, Par j 2 постенницы и Ole e 7 маслины) и пищевых (Pru p 3 персика, Cor a 8 фундука, Jug r 3 грецкого ореха, Ara h 9 арахиса и Tri a 14 пшеницы) аллергенных ЛTБ.
временное направление развития аллергодиаг-ностики основано на замене суммарных экстрактов на индивидуальные белковые аллергокомпоненты, которые могут быть использованы для составления молекулярного профиля чувствительности пациента и изучения перекрестной реактивности аллергенов [111]. В современных тест-системах в формате микрочипов, предназначенных для компонент-разрешающей диагностики, на сегодняшний день уже используются несколько природных и рекомбинант-ных пыльцевых (Art v 3 полыни, Pla a 3 платана, Par j 2 постенницы и Ole e 7 маслины) и пищевых (Pru p 3 персика, Cor a 8 фундука, Jug r 3 грецкого ореха, Ara h 9 арахиса и Tri a 14 пшеницы) аллергенных ЛTБ.
Современный метод снижения реактивности организма — аллерген-специфическая иммунотерапия (АСИТ), при которой пациенту вводятся постепенно повышающиеся дозы аллергена [112]. Однако традиционно при АСИТ используют неочищенные экстракты или аллергоиды, которые характеризуются низкой эффективностью и высоким риском развития системных аллергических реакций. Наиболее безопасное и перспективное направление АСИТ предполагает разработку и создание вакцин на основе индивидуальных природных и рекомбинантных аллергенов, а также их гипоаллергенных аналогов. Эти аналоги должны обладать низкой аллергенно-стью, но достаточно высокой иммуногенностью, чтобы не вызывать побочных аллергических реакций и надолго снижать гиперчувствительность организма [113]. Гипоаллергенные формы создаются в основном с помощью методов рационального дизайна и сайт-направленного мутагенеза путем замены аминокислотных остатков, входящих в состав В-клеточных эпитопов. На сегодняшний день несколько гипоал-лергенных аналогов основных пыльцевых и пищевых аллергенов различных классов проходят клинические испытания в качестве лекарственных препаратов для проведения АСИТ [114]. К настоящему времени получены гипоаллергенные формы ряда растительных ЛТБ, например, Par j 2 постенницы [115] и Pru p 3 персика [116], но среди препаратов, проходящих клинические испытания, пока отсутствуют вакцины на основе гипоаллергенных форм растительных ЛТБ.
ЗАКЛЮЧЕНИЕ
ЛТБ широко распространены в царстве растений, присутствуют практически во всех растительных органах и тканях, имеют внутри- или внеклеточную локализацию и играют важную физиологическую роль. ЛТБ, кодируемые мультигенным семейством, в растениях представлены набором множественных изоформ, дифференциально экспрессирующихся в различных органах и тканях в условиях воздействия различных стрессогенных факторов окружающей среды. Помимо этого, в растениях обнаружены разнообразные ЛТБ-подобные белки, которые имеют сильно отличающуюся структуру и функциональную
СПИСОК ЛИТЕРАТУРЫ
1. Abdelkader A.B., Mazliak P. // Eur. J. Biochem. 1970. V. 15. P. 250-262.
2. Vergnolle C., Arondel V., Jolliot A., Kader J. // Methods Enzy-mol. 1992. V. 209. P. 522-530.
3. Kader J.-C. // Annu. Rev. Plant. Physiol. Plant. Mol. Biol. 1996. V. 47. P. 627-654.
4. Perrocheau L., Bakan B., Boivin P., Marion D. // J. Agricult. Food Chem. 2006. V. 54. № 8. P. 3108-3113.
активность. Предполагается, что появление в ходе эволюции множественных изоформ ЛТБ и ЛТБ-подобных белков обусловлено необходимостью расширения спектра функций, выполняемых этими белками.
Биологическая роль ЛТБ в растениях изучена не до конца. Показано, что ЛТБ принимают участие во многих процессах, что, вероятно, во многом обусловлено их способностью связывать и переносить разнообразные молекулы липидов.
Достоверно установлено, что ЛТБ относятся к молекулярным факторам системы врожденного иммунитета растений.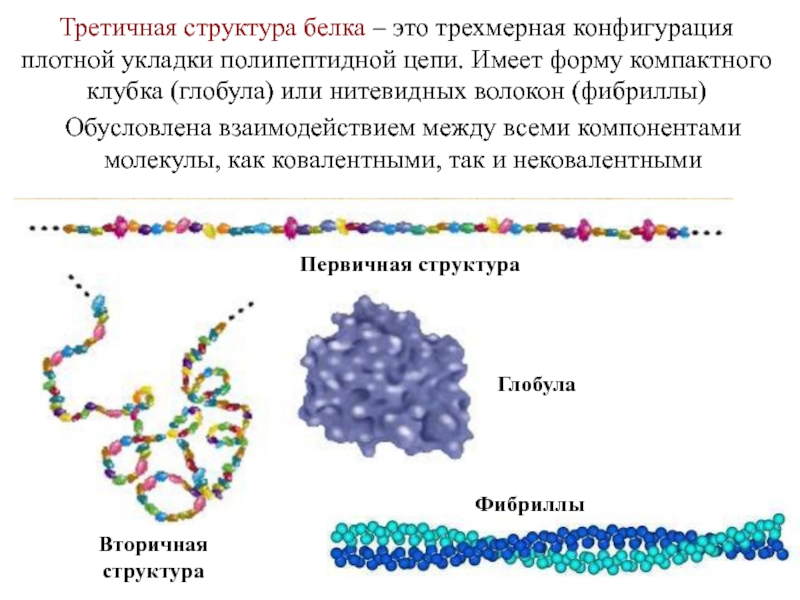 Являясь компонентами семейства РИР — белков, связанных с патогенезом, ЛТБ принадлежат к защитной системе растений, позволяющей им быстро адаптироваться и выживать в условиях стресса. Защитная функция ЛТБ обусловлена их антимикробной активностью и способностью ингиби-ровать чужеродные ферменты, участием в переносе сигнальных медиаторов, защитных и строительных липидов, а также свойствами эндогенных элисито-ров, которые в комплексе с молекулой липида распознаются специфическими рецепторами и запускают иммунный ответ.
Являясь компонентами семейства РИР — белков, связанных с патогенезом, ЛТБ принадлежат к защитной системе растений, позволяющей им быстро адаптироваться и выживать в условиях стресса. Защитная функция ЛТБ обусловлена их антимикробной активностью и способностью ингиби-ровать чужеродные ферменты, участием в переносе сигнальных медиаторов, защитных и строительных липидов, а также свойствами эндогенных элисито-ров, которые в комплексе с молекулой липида распознаются специфическими рецепторами и запускают иммунный ответ.
ЛТБ играют важную роль в жизни человека. Широкое распространение и сходная пространственная организация делают эти белки одним из важнейших классов перекрестных растительных аллергенов, являющихся частой причиной развития аллергических реакций различной степени тяжести. Поверхностно-активные и аллергенные свойства, а также способность ЛТБ связывать и переносить гидрофобные лиганды делают возможным применение этих белков в фармации для конструирования систем доставки лекарственных и косметических средств, в аллергологии для создания современных диагностических тест-систем и препаратов для аллерговак-цинации, в пищевой промышленности для производства высококачественных сортов пива и в сельском хозяйстве для получения растений, устойчивых к стрессу. •
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-50-00131).
5. Lee J.Y., Min K., Cha H., Hwang D.H.S.K.Y., Suh S.W. // J. Mol. Biol. 1998. V. 276. P. 437-448.
6. Gizatullina A.K., Finkina E.I., Mineev K.S., Melnikova D.N., Bogdanov I.V., Telezhinskaya I.N., Balandin S.V., Shenkarev Z.O., Arseniev A.S., Ovchinnikova T.V. // Biochem. Biophys. Res. Commun. 2013. V. 439. № 4. P. 427-432.
7. Simorre J., Caille A., Dominique M. , Didier M., Ptak M. // Biochemistry. 1991. V. 30. P. 11600-11608.
, Didier M., Ptak M. // Biochemistry. 1991. V. 30. P. 11600-11608.
8. Yeasts T.H., Rose J.K.C. // Protein Sci. 2007. V. 17. P. 191-198.
9. Gomar J., Petit M.-C., Sodano P., Sy D., Marion D., Kader J.-C., Vovelle F., Ptak M. // Protein Sci. 1996. V. 5. № 4. P. 565-577.
10. Samuel D., Liu Y.J., Cheng C.S., Lyu P.C. // J. Biol. Chem. 2002. V. 277. P. 35267-35273.
11. Hoh F., Pons J.L., Gautier M.F., de Lamotte F., Dumas C. // Acta Crystallogr. D. Biol. Crystallogr. 2005. V. 61. P. 397-406.
12. Pons J.L., de Lamotte F., Gautier M.F., Delsuc M.A. // J. Biol. Chem. 2003. V. 278. P. 14249-14256.
13. Cheng C.S., Chen M.N., Lai Y.T., Chen T., Lin K.F., Liu Y.J., Lyu P.C. // Proteins. 2008. V. 70. № 3. P. 695-706.
14. Tassin S., Broekaert W.F., Marion D., Acland D.P., Ptak M., Vovelle F., Sodano P. // Biochem. 1998. V. 37. P. 3623-3637.
15. Cheng C.S., Chen M.N., Liu Y.J., Huang L.Y., Lin K.F., Lyu P.Ch. // Enzyme Microb. Technol. 2004. V. 35. P. 532-539.
16. Pato C., Borgne M., Baut G., Papec P., Marion D., Douliez J.-P. // Biochem. Pharmacol. 2001. V. 62. P. 555-560.
17. Tassin-Moindrot S., Caille A., Douliez J.P., Marion D., Vovelle F. // Eur. J. Biochem. 2000. V. 267. P. 1117-1124.
18. Douliez J.-P., Michon T., Marion D. // Biochim. Biophys. Acta. 2000. V. 1467. P. 65-72.
19. Charvolin D., Douliez J.-P., Marion D., Cohen-Addad C., Pebay-Peyroula E. // Eur. J. Biochem. 1999. V. 264. P. 562-568.
// Eur. J. Biochem. 1999. V. 264. P. 562-568.
20. Cheng H., Cheng P., Peng P., Lyu P., Sun Y. // Protein Sci. 2004. V. 13. P. 2304-2315.
21. Buhot N., Gomes E., Milat M.L., Ponchet M., Marion D., Lequeu J., Delrot S., Coutos-Thévenot P., Blein J.P. // Mol. Biol. Cell. 2004. V. 15. № 11. P. 5047-5052.
22. Li C., Xie W., Bai W., Li Z., Zhao Y., Liu H. // FEBS J. 2008. V. 275. № 21. P. 5298-5308.
23. Wang Z., Xie W., Chi F., Li C. // FEBS Lett. 2005. V. 579. № 7. P. 1683-1687.
24. Guerbette F., Grosbois M., Jolliot-Croquin A. // Mol. Cell. Biochem. 1999. V. 192. P. 157-161.
25. Guerbette F., Grosbois M., Jolliot-Croquin A., Kader J.-C., Zachowski A. // Biochemistry. 1999. V. 38. P. 14131-14137.
26. Ostergaard J., Vergnolle C., Schoentgen F., Kader J.-C. // Biochim. Biophys. Acta. 1993. V. 1170. P. 109-117.
27. Douliez J.-P., Pato C., Rabesona H., Molle D., Marion D. // Eur. J. Biochem. 2001. V. 268. P. 1400-1403.
28. Bakan B., Hamberg M., Larue V., Prangé T., Marion D., Las-combe M.B. // Biochem. Biophys. Res. Commun. 2009. V. 390. P. 780-785.
29. Bakan B., Hamberg M., Perrocheau L., Maume D., Rogniaux H., Tranquet O., Rondeau C., Blein J.P., Ponchet M., Marion D. // J. Biol. Chem. 2006. V. 281. № 51. P. 38981-38988.
30. Regente M.C., Giudici A.M., Villalaín J., de la Canal L. // Lett. Appl. Microbiol. 2005. V. 40. P. 183-189.
31. Caaveiro J. M.M., Molina A., González-Mañas J.M., Rodrí-guez-Palenzuela P., García-Olmedo F., Goñi F.M. // FEBS Lett. 1997. V. 410. P. 338-342.
M.M., Molina A., González-Mañas J.M., Rodrí-guez-Palenzuela P., García-Olmedo F., Goñi F.M. // FEBS Lett. 1997. V. 410. P. 338-342.
32. Hoffmann-Sommergruber K. // Biochem. Society Transactions. 2002. V. 30. P. 930-935.
33. van Loon L.C., Rep M., Pieterse C.M. // Annu. Rev. Phyto-pathol. 2006. V. 44. P. 135-162.
34. Edreva A. // Gen. Appl. Plant Physiol. 2005. V. 31. P. 105-124.
35. Douliez J., Michon T., Elmorjani K., Marion D. // J. Cereal Sci. 2000. V. 32. P. 1-20.
36. Carvalho A.O., Gomes V.M. // Peptides. 2007. V. 28. P. 11441153.
37. Tsuboi S., Osafune T., Tsugeki R., Nishimura M., Yamada M. // Biochem. 1992. V. 3. P. 500-508.
38. Carvalho A.O., Teodoro C.E.S., Da Cunha M., Okorokova-Facanha A.L., Okorokov L.A., Fernandes K.V.S., Gomes V.M. // Physiol. Plant. 2004. V. 122. P. 328-336.
39. Diz M.S., Carvalho A.O., Ribeiro S.F., Da Cunha M., Beltra-
mini L., Rodrigues R., Nascimento V.V., Machado O.L., Gomes V.M. // Physiol. Plant. 2011. V. 142. № 3. P. 233-246.
40. Pagnussat L., Burbach C., Baluska F., de la Canal L. // J. Exp. Bot. 2012. V. 63. № 18. P. 6555-6563.
41. Edstam M.M., Edqvist J. // Physiol Plant. 2014. V. 152. № 1. P. 32-42.
42. Kobayashi Y., Motose H., Iwamoto K., Fukuda H. // Plant Cell Physiol. 2011. V. 52. № 6. P. 1095-1106.
43. Chae K., Gonong B.J., Kim S. C., Kieslich C.A., Morikis D., Balasubramanian S., Lord E.M. // J. Exp. Bot. 2010. V. 61. № 15. P. 4277-4290.
C., Kieslich C.A., Morikis D., Balasubramanian S., Lord E.M. // J. Exp. Bot. 2010. V. 61. № 15. P. 4277-4290.
44. Garcia-Olmedo F., Molina A., Segura A., Moreno M. // Trends in Microbiology. 1995. V. 3. № 2. P. 72-74.
45. Choi A.M., Lee S.B., Cho S.H., Hwang I., Hur C.-G., Suh M.C. // Plant Physiol. Biochem. 2008. V. 46. P. 127-139.
46. Thoma S., Hecht U., Kippers A., Botella J., De Vries S., Somerville C. // Plant Physiol. 1994. V. 105. P. 35-45.
47. Jung H.W., Kim W., Hwang B.K. // Plant Cell Environ. 2003. V. 26. № 6. P. 915-928.
48. Gomes E., Sagot E., Gaillard C., Laquitaine L., Poinssot B., Sanejouand Y.H., Delrot S., Coutos-Thévenot P. // Mol. Plant Microbe Interact. 2003. V. 16. № 5. P. 456-464.
49. Wang C., Yang C., Gao C., Wang Y. // Tree Physiol. 2009. V. 29. № 12. P. 1607-1619.
50. Trevino M.B., O’Conell M.A. // Plant Physiol. 1998. V. 116. P. 1461-1468.
51. Zottich U., Da Cunha M., Carvalho A.O., Dias G.B., Silva N.C., Santos I.S., do Nacimento V.V., Miguel E.C., Machado O.L., Gomes V.M. // Biochim. Biophys. Acta. 2011. V. 1810. № 4. P. 375-383.
52. Cammue B.P.A., Thevissen K., Hendriks M., Eggermont K., Goderis L.J., Proost P., Damme J.V., Osborn R.W., Guerbette F., Kader J., Broekaert W.F. // Plant Physiol. 1995. V. 109.
P. 445-455.
53. Segura A., Moreno M., García-Olmedo F. // FEBS Lett. 1993. V. 332. № 3. P. 243-246.
54.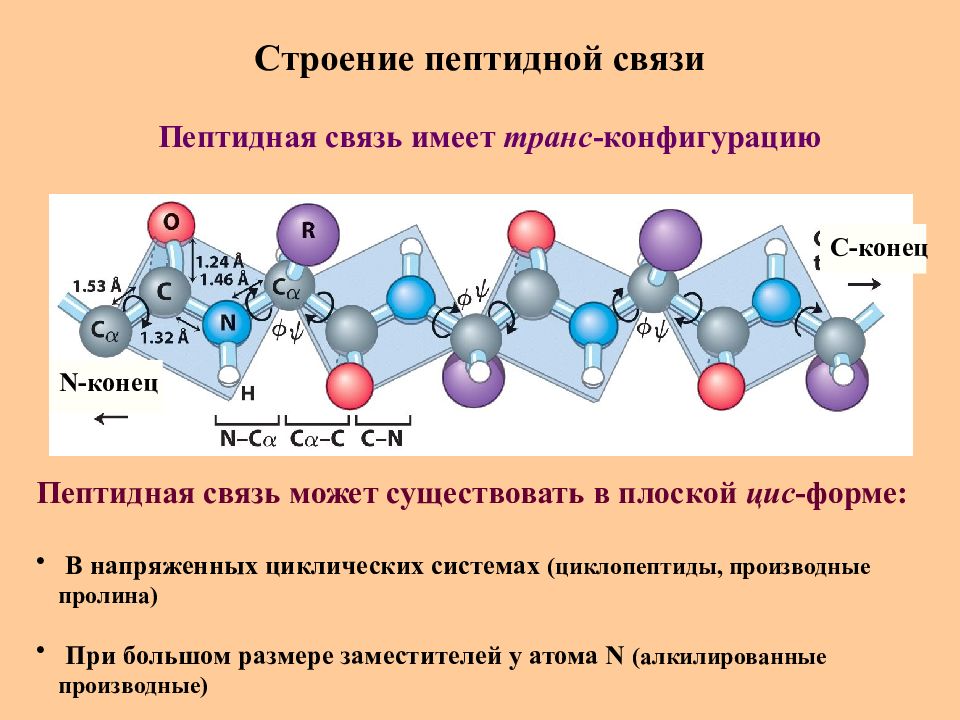 Dubreil L., Gaborit T., Bouchet B., Gallant D.J., Broekaert W.F., Quillien L., Quillien L., Marion D. // Plant Sci. 1998.
Dubreil L., Gaborit T., Bouchet B., Gallant D.J., Broekaert W.F., Quillien L., Quillien L., Marion D. // Plant Sci. 1998.
V. 138. P. 121-135.
55. Molina A., Segura A., Garcia-Olmedo F. // FEBS. 1993. V. 316. P. 119-122.
56. Sun J.Y., Gaudet D.A., Lu Z.X., Frick M., Puchalski B., Laroche A. // Mol. Plant Microbe Interact. 2008. V. 21. № 3. P. 346-360.
57. Ge X., Chen J., Sun C., Cao K. // Prot. Eng. 2003. V. 16. P. 387-390.
58. Ooi L.S., Tian L., Su M., Ho W.S., Sun S.S., Chung H.Y., Wong H.N., Ooi V.E. // Peptides. 2008. V. 29. № 12. P. 2101-2109.
59. Lin P., Xia L., Wong J.H., Ng T.B., Ye X., Wang S., Shi X. // J. Pept. Sci. 2007. V. 13. № 10. P. 642-648.
60. Zhang N., Jonnes B.L., Tao H.P. // Cereal Chem. 1997. V. 74. № 2. P. 119-122.
61. Melo F.R., Rigden D.J., Franco O.L., Mello L.V., Ary M.B., Grossi de Sa M.F., Bloch C. // Proteins. 2002. V. 48. № 2. P. 311-319.
62. Jones B.L., Marinac L.A. // J. Agric. Food Chem. 2000. V. 48. P. 257-264.
63. Sawano Y., Hatano K., Miyakawa T., Komagata H., Miyauchi Y., Yamazaki H., Tanokura M. // Plant Physiol. 2008. V. 146. № 4. P. 1909-1919.
64. Chae K., Kieslich C., Morikis D., Kim S., Lord E.M. // Plant Cell. 2009. V. 21. P. 3902-3914.
65. Zhang D., Liang W., Yin C., Zong J., Gu F., Zhang D. // Plant Physiol. 2010. V. 154. № 1. P. 149-162.
66.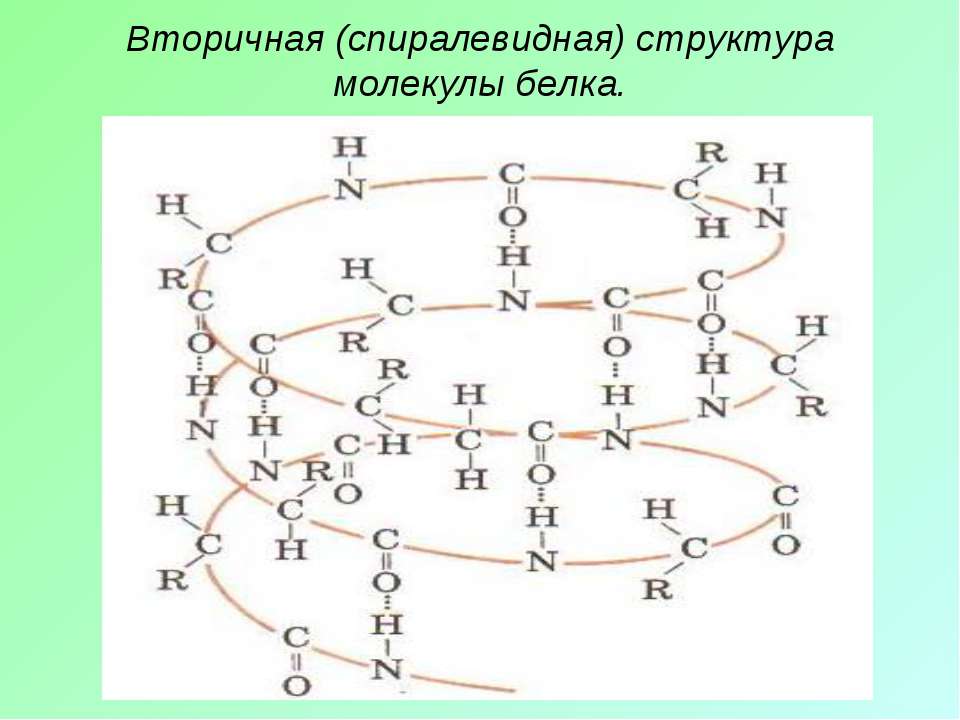 Cameron K.D., Teece M.A., Smart L.B. // Plant Physiol. 2006. V. 140. P. 176-183.
Cameron K.D., Teece M.A., Smart L.B. // Plant Physiol. 2006. V. 140. P. 176-183.
67. Lee S.B., Go Y.S., Bae H.J., Park J.H., Cho S.H., Cho H.J., Lee
D.S., Park O.K., Hwang I., Suh M.C. // Plant Physiol. 2009. V. 150. № 1. P. 42-54.
68. Kader J.-C. // Trends Plant Science. 1997. V. 2. № 2. P. 66-70.
69. Sterk P., Booij H., Schellekens G.A., van Kammen A., De Vries S.C. // Plant Cell. 1991. V. 3. P. 907-921.
70. Park S.Y., Jauh G.Y., Mollet J.C., Eckard K.J., Nothnagel E.A., Walling L.L., Lord E.M. // Plant Cell. 2000. V. 12. P. 151-163.
71. Ouvard O., Cellier F., Ferrare K., Tousch D., Lamaze T., Dupuis J.M., Casse-Delbart F. // Plant Mol. Biol. 1996. V. 31. P. 819-829.
72. Hincha D.K. // Phil. Trans. R. Soc. Lond. 2002. V. 357. P. 909-916.
73. Choi Y.E., Lim S., Kim H.J., Han J.Y., Lee M.H., Yang Y., Kim J.A., Kim Y.S. // Plant J. 2012. V. 70. № 3. P. 480-491.
74. Sror H.A., Tischendorf G., Sieg F., Schmitt J.M., Hincha D.K. // Cryobiology. 2003. V. 47. № 3. P. 191-203.
75. Cheng C.S., Samuel D., Liu Y.J., Shyu J.C., Lai S.M., Lin K.F., Lyu P.C. // Biochemistry. 2004. V. 43. P. 13628-13636.
76. Wang X., Wang H., Cao K., Ge X. // Mol. Biol. Rep. 2009. V. 36. P. 745-750.
77. Osman H., Vauthrin S., Mikes V., Milat M.L., Panabieres F., Marais A., Brunie S., Maume B., Ponchet M., Blein J.P. // Mol. Biol. Cell. 2001.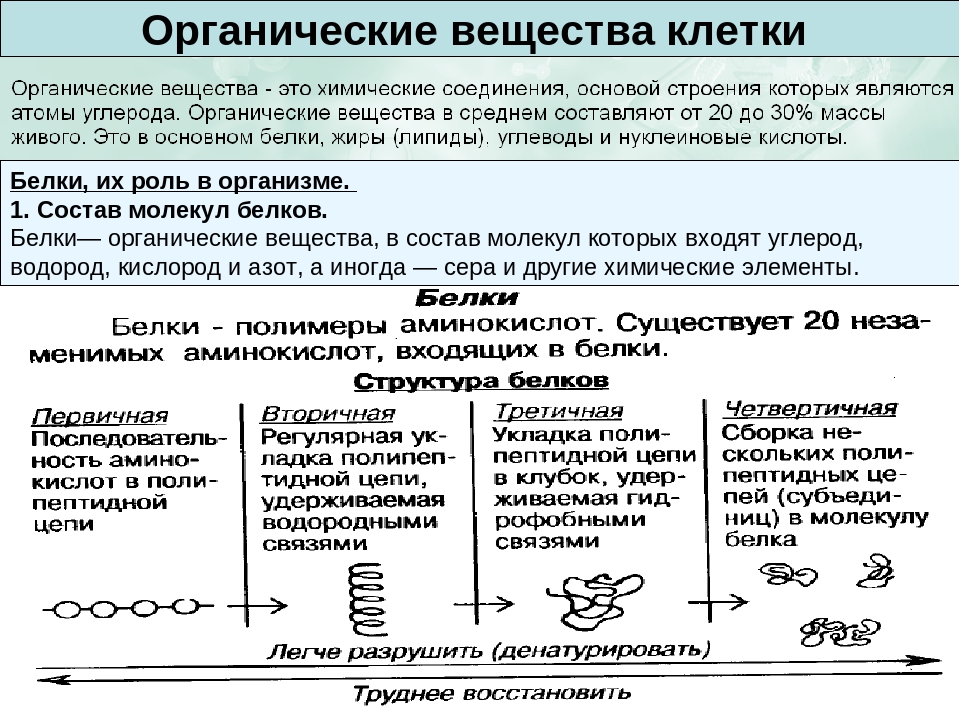 V. 12. P. 2825-2834.
V. 12. P. 2825-2834.
78. Kim Y.T., Oh J., Kim K.H., Uhm J.Y., Lee B.M. // Mol. Biol. Rep. 2010. V. 37. № 2. P. 717-727.
79. Douliez N., Jacquemard A., Marion D., Tran V., Maume B., Milat M., Ponchet M., Mikes V., Kader J.-C., Blein J. // FEBS Lett. 2001. V. 509. № 1. P. 27-30.
80. Maldonado A.M., Doerner P., Dixon R.A., Lamb C.J., Cameron R.K. // Nature. 2002. V. 419. № 6905. P. 399-403.
81. Lascombe M.B., Bakan B., Buhot N., Marion D., Blein J.P., Larue V., Lamb C., Prangé T. // Protein Sci. 2008. V. 17. № 9. P. 1522-1530.
82. Degli Esposti M. // Biochim. Biophys. Acta. 2002. V. 1553. № 3. P. 331-340.
83. Crimi M., Astegno A., Zoccatelli G., Esposti M.D. // Arch. Biochem. Biophys. 2006. V. 445. № 1. P. 65-71.
84. Rudrappa T., Biedrzycki M.L., Kunjeti S.G., Donofrio N.M., Czymmek K.J., Paré P.W., Bais H.P. // Commun. Integr. Biol. 2010. V. 3. № 2. P. 130-138.
85. Pii Y., Astegno A., Peroni E., Zaccardelli M., Pandolfini T., Crimi M. // Mol. Plant Microbe Interact. 2009. V. 22. № 12. P. 1577-1587.
86. Pii Y., Molesini B., Pandolfini T. // Plant Signal Behav. 2013. V. 8. № 7. e24836.
87. Tomassen M.M., Barrett D.M., van der Valk H.C., Woltering
E.J. // J. Exp. Bot. 2007. V. 58. № 5. P. 1151-1160.
88. Palacin A., Varelaw J., Quirce S., del Pozo V. // Clin. Exp. Allergy. 2009. V. 39. P. 1267-1276.
89.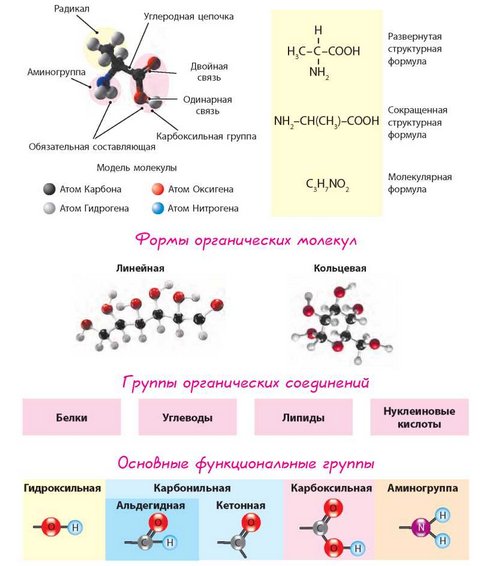 Salcedo G., Sanchez-Monge R., Diaz-Perales A., Garcia-Casado G., Barber D. // Clin. Exp. Allergy. 2004. V. 34. № 9. P. 1336-1341.
Salcedo G., Sanchez-Monge R., Diaz-Perales A., Garcia-Casado G., Barber D. // Clin. Exp. Allergy. 2004. V. 34. № 9. P. 1336-1341.
90. Hauser M., Roulias A., Ferreira F., Egger M. // Allergy Asthma Clin. Immunol. 2010. V. 6. № 1. P. 1-14.
91. Borges J.P., Barre A., Culerrier R., Granier C., Didier A., Rougé P // Biochem. Biophys. Res. Commun. 2008. V. 365. № 4. P. 685-690.
92. Akkerdaas J., Finkina E.I., Balandin S.V., Santos Magadán S., Knulst A., Fernandez- Rivas M., Asero R., van Ree R., Ovchin-nikova T.V. // Int. Arch. Allergy Immunol. 2012. V. 157. P. 51-57.
93. Borges J.P., Jauneau A., Brule C., Culerrier R., Barre A., Didier A., Rougé P. // Plant Physiol. Biochem. 2006. V. 44. P. 535-542.
94. Fernandez-Rivas M., Gonzalez-Mancebo E., Rodriguez-Perez R., Benito C., Sanchez-Monge R., Salcedo G., Alonso M.D., Rosado A., Tejedor M.A., Vila C., et al. // J. Allergy Clin. Immunol. 2003. V. 112. P. 789-795.
95. Egger M., Hauser M., Mari A., Ferreira F., Gadermaier G. // Curr. Allergy Asthma Rep. 2010. V. 10. № 5. P. 326-335.
96. Marzban G., Mansfeld A., Herndl A., Jäger S., Stoyanova M. E., Hemmer W., Katinger H., Laimer M. // Aerobiologia. 2006. V. 22. P. 237-245.
97. Fernández-Rivas M., Bolhaar S., González-Mancebo E., Asero R., van Leeuwen A., Bohle B., Ma Y., Ebner C., Rigby N., Sancho A.I., et al. // J. Allergy Clin. Immunol. 2006. V. 118. P. 481-488.
98. Pacios L.F., Tordesillas L., Cuesta-Herranz J., Compes E., Sánchez-Monge R., Palacín A., Salcedo G., Díaz-Perales A. // Mol. Immunol.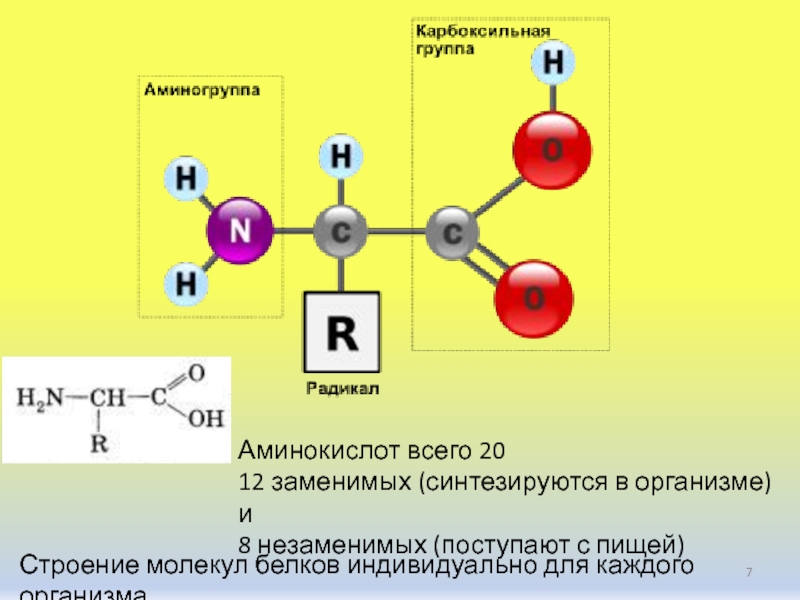 2008. V. 45. № 8. P. 2269-2276.
2008. V. 45. № 8. P. 2269-2276.
99. García-Casado G., Pacios L.F., Díaz-Perales A., Sánchez-Monge R., Lombardero M., García-Selles F.J., Polo F., Barber D., Salcedo G. // J. Allergy Clin. Immunol. 2003. V. 112. P. 599-605.
100. Salcedo G., Sanchez-Monge R., Barber D., Diaz-Perales A. // Biochim. Biophys. Acta. 2007. V. 1771. P. 781-791.
101. Tordesillas L., Cuesta-Herranz J., Gonzalez-Muñoz M., Pacios L.F., Compés E., Garcia-Carrasco B., Sanchez-Monge R., Salcedo G., Diaz-Perales A. // Mol. Immunol. 2009. V. 46. P. 722-728.
102. Schulten V., Radakovics A., Hartz C., Mari A., Vazquez-Cortes S., Fernandez-Rivas M., Lauer I., Jahn-Schmid B., Eiwegger T., Scheurer S., et al. // J. Allergy Clin. Immunol. 2009. V. 124. № 1. P. 100-107.
103. Edstam M.M., Viitanen L., Salminen T.A., Edqvist J. // Mol. Plant. 2011. V. 4. № 6. P. 947-964.
104. Boutrot F., Chantret N. Gautier M.-F. // BMC Genomics.
2008. V. 9. № 86. P. 1-19.
105. Jang C.S., Jung J.H., Yim W.C., Lee B.M., Seo Y.W., Kim W. // Mol. Cell. 2007. V. 24. № 2. P. 215-223.
106. Moore R.C., Purugganan M.D. // Curr. Opin. Plant Biol. 2005. V. 8. P. 122-128.
107. Nieuwoudt M., Lombard N., Rautenbach M. // Food Chem. 2014. V. 157. P. 559-567.
108. Safi H., Saibi W., Alaoui M.M., Hmyene A., Masmoudi K., Hanin M., Brini F. // Plant Physiol Biochem. 2015. V. 89. P. 64-75.
109. Wang F., Zang X. S., Kabir M.R., Liu K.L., Liu Z.S., Ni Z.F., Yao Y.Y., Hu Z.R., Sun Q.X., Peng H.R. // Gene. 2014. V. 550. № 1. P. 18-26.
S., Kabir M.R., Liu K.L., Liu Z.S., Ni Z.F., Yao Y.Y., Hu Z.R., Sun Q.X., Peng H.R. // Gene. 2014. V. 550. № 1. P. 18-26.
110. Guo C., Ge X., Ma H. // Plant Mol. Biol. 2013. V. 82. № 3. P. 239-253.
111. Van Winkle R.C., Chang C. // Clin. Rev. Allergy Immunol. 2014. V. 46. № 3. P. 211-224.
112. Bidad K., Nicknam M.H., Farid R. // Iran J. Allergy Asthma Immunol. 2011. V. 10. № 1. P. 1-9.
113. Mutschlechner S., Deifl S., Bohle B. // Clin. Exp. Allergy.
2009. V. 39. № 11. P. 1635-1642.
114. Cromwell O., Häfner D., Nandy A. // J. Allergy Clin. Immunol. 2011. V. 127. № 4. P. 865-872.
115. Bonura A., Passantino R., Costa M.A., Montana G., Melis M., Bondi M.L., Butteroni C., Barletta B., Corinti S., Di Felice G., et al. // Clin. Exp. Allergy. 2012. V. 42. № 3. P. 471-480.
116. Gómez-Casado C., Garrido-Arandia M., Gamboa P., Blanca-López N., Canto G., Varela J., Cuesta-Herranz J., Pacios L.F., Díaz-Perales A., Tordesillas L. // Clin. Dev. Immunol. 2013.
V. 2013. P. 1-12.
§4. Свойства и функции белков
1. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул?
Процесс нарушения природной структуры белков под влиянием каких-либо факторов без разрушения первичной структуры называется денатурацией. Денатурация белков может быть вызвана действием различных факторов, например, высокой температуры, концентрированных кислот и щелочей, тяжёлых металлов.
2. Чем фибриллярные белки отличаются от глобулярных? Приведите примеры фибриллярных и глобулярных белков.
Молекулы фибриллярных белков имеют вытянутую, нитевидную форму. Глобулярные белки характеризуются компактной округлой формой молекул. К фибриллярным белкам относятся, например, кератин, коллаген, миозин. Глобулярными белками являются глобулины и альбумины крови, фибриноген, гемоглобин и др.
3. Назовите основные биологические функции белков, приведите соответствующие примеры.
● Структурная функция. Белки входят в состав всех клеток и межклеточного вещества, являются компонентами различных структур живых организмов. Например, у животных белок коллаген входит в состав хрящей и сухожилий, эластин – в состав связок и стенок кровеносных сосудов, кератин является важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт.
● Ферментативная (каталитическая) функция. Белки-ферменты являются биологическими катализаторами, ускоряя протекание химических реакций в живых организмах. Например, пищеварительные ферменты амилаза и мальтаза расщепляют сложные углеводы до простых, пепсин – белки до пептидов, под действием липаз происходит расщепление жиров до глицерина и карбоновых кислот.
● Транспортная функция. Многие белки способны присоединять и переносить различные вещества. Например, гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют высшие карбоновые кислоты, а глобулины – ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из неё.
● Сократительная (двигательная) функция. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Например, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения, тубулин входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.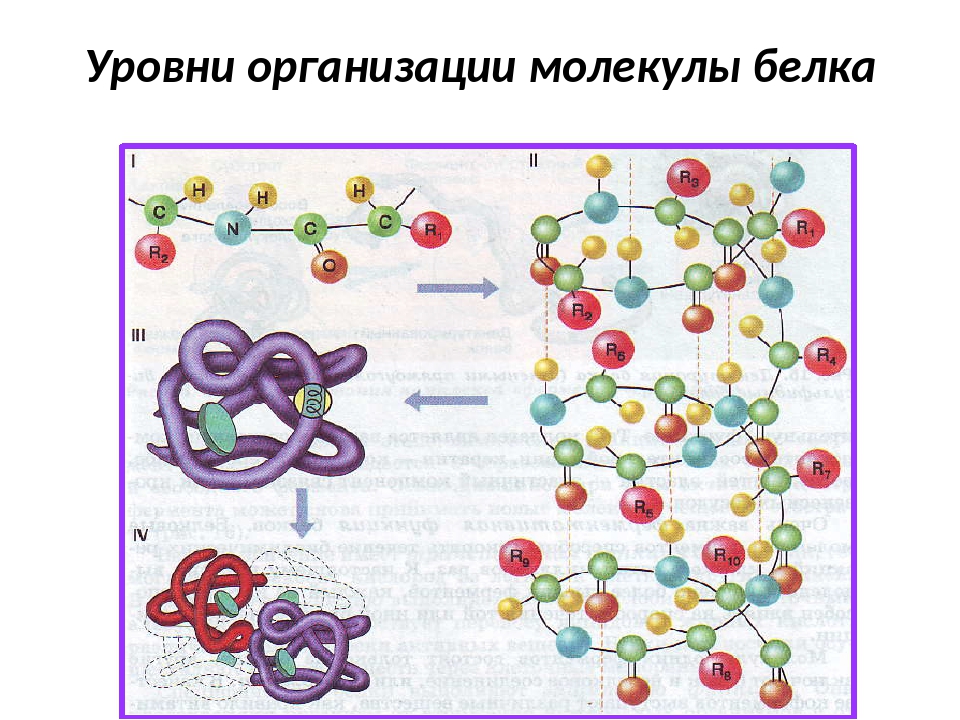
● Регуляторная функция. Некоторые белки и пептиды участвуют в регуляции различных физиологических процессов. Например, гормоны белково-пептидной природы инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) – процессы роста и физического развития.
● Сигнальная функция заключается в том, что некоторые белки, входящие в состав цитоплазматической мембраны клеток, в ответ на действие внешних факторов изменяют свою пространственную конфигурацию, тем самым обеспечивая приём сигналов из внешней среды и передачу информации в клетку. Например, белок опсин, входящий в состав пигмента родопсина, воспринимает свет и обеспечивает возникновение зрительного возбуждения рецепторов (палочек) сетчатки глаза.
● Защитная функция. Белки предохраняют организм от вторжения чужеродных объектов и от повреждений. Например, иммуноглобулины (антитела) участвуют в иммунном ответе, интерферон защищает организм от вирусной инфекции. Фибриноген, тромбопластин и тромбин обеспечивают свёртывание крови, предотвращая кровопотерю.
● Токсическая функция. Многие живые организмы выделяют белки-токсины, которые являются ядами для других организмов.
● Энергетическая функция. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6 кДж энергии.
● Запасающая функция. Например, в семенах растений запасаются особые белки, которые используются при прорастании зародышем, а затем и проростком в качестве источника азота.
4. Что такое ферменты? Почему без их участия протекание большинства биохимических процессов в клетке было бы невозможным?
Ферменты – белки, которые выполняют функцию биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах. Они катализируют реакции синтеза и расщепления различных веществ. Без участия ферментов эти процессы протекали бы слишком медленно или не протекали бы вовсе. Практически все процессы жизнедеятельности организмов обусловлены ферментативными реакциями.
Практически все процессы жизнедеятельности организмов обусловлены ферментативными реакциями.
5. В чем заключается специфичность ферментов? Какова её причина? Почему ферменты активно функционируют лишь в определённом диапазоне температуры, рН и других факторов?
Специфичность ферментов заключается в том, что каждый фермент ускоряет только одну реакцию либо действует только на определённый тип связи. Эта особенность объясняется соответствием пространственной конфигурации активного центра фермента тому или иному субстрату (субстратам).
Ферменты являются белками. Изменение рН, температуры и других факторов может вызвать денатурацию ферментов, в результате чего они теряют способность связываться со своими субстратами.
6. Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
Белки – основа жизни. Они выполняют чрезвычайно важные биологические функции, многие из которых (ферментативную, транспортную, двигательную и др.) не способны выполнять ни углеводы, ни жиры. Белки, использованные в качестве энергетического субстрата, дают столько же энергии, сколько и углеводы (1 г – 17,6 кДж) и в 2,2 раза меньше, чем жиры (1 г – около 39 кДж). Кроме того, при полном расщеплении белков (в отличие от углеводов и жиров) образуются не только СО2 и Н2О, но также соединения азота и серы, причём некоторые из них токсичны для организма (например, NH3). Поэтому энергетическую функцию у живых организмов выполняют прежде всего углеводы и жиры.
7*. У многих бактерий в процессах синтеза веществ, необходимых для нормального роста и размножения, участвует парааминобензойная кислота (ПАБК). В то же время в медицине для лечения ряда бактериальных инфекций используются сульфаниламиды — вещества, по структуре сходные с ПАБК. Как вы думаете, на чём основано лечебное действие сульфаниламидов?
С помощью фермента (дигидроптероатсинтетазы) бактерии осуществляют превращение ПАБК в продукт (дигидроптероевую кислоту), который далее используется для синтеза необходимых ростовых факторов.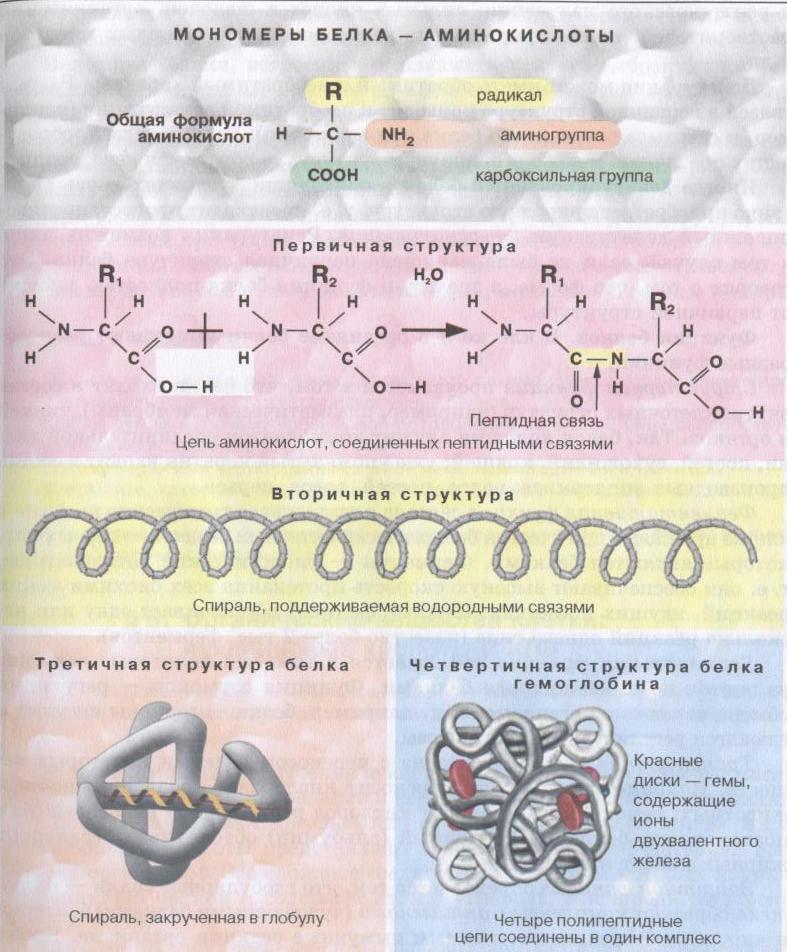 Из-за структурного сходства с ПАБК, сульфаниламиды также способны связываться с активным центром этого фермента, блокируя его работу (т.е. наблюдается конкурентное ингибирование). Это ведёт к нарушению синтеза ростовых факторов и нуклеиновых кислот у бактерий.
Из-за структурного сходства с ПАБК, сульфаниламиды также способны связываться с активным центром этого фермента, блокируя его работу (т.е. наблюдается конкурентное ингибирование). Это ведёт к нарушению синтеза ростовых факторов и нуклеиновых кислот у бактерий.
* Задания, отмеченные звёздочкой, предполагают выдвижение учащимися различных гипотез. Поэтому при выставлении отметки учителю следует ориентироваться не только на ответ, приведённый здесь, а принимать во внимание каждую гипотезу, оценивая биологическое мышление учащихся, логику их рассуждений, оригинальность идей и т. д. После этого целесообразно ознакомить учащихся с приведённым ответом.
Дашков М.Л.
Сайт: dashkov.by
Вернуться к оглавлению
| < Предыдущая | Следующая > |
|---|
Белок заряд суммарный — Справочник химика 21
Сравнительно недавно разработан метод электрофореза на полиакриламидном геле. Метод характеризуется высокой разрешающей способностью и применяется для фракционирования и определения размеров, конфигурации и суммарного заряда молекул (белков, нуклеиновых кислот и др.) см. обзор 24]. [c.399]Наконец, следует указать на своеобразие радикалов, которые являются полифункциональными, несущими свободные МН,-, СООН-, ОН-, 8Н-группы и, как было указано, определяют структуру (пространственную) и многообразие функций молекул белка. Взаимодействуя с окружающими молекулами растворителя (Н,0), функциональные группы (в частности, КН,- и СООН-группы) ионизируются, что приводит к образованию анионных и катионных центров белковой молекулы. В зависимости от соотношения ионов молекулы белка получают суммарный положительный (+) или отрицательный (—) заряд с определенным значением изоэлектрической точки. [c.52]
Очевидно, должна существовать такая концентрация ионов водорода, при которой число ионизированных основных групп равно числу ионизированных кислотных групп, т.
 е. суммарный заряд макромолекулы равен нулю. Такое состояние белка, при котором число ионизированных основных и кислотных групп в молекуле одинаково, называется изоэлектрическим состоянием, а значение pH, которое соответствует изоэлектрическому состоянию, называется [c.262]
е. суммарный заряд макромолекулы равен нулю. Такое состояние белка, при котором число ионизированных основных и кислотных групп в молекуле одинаково, называется изоэлектрическим состоянием, а значение pH, которое соответствует изоэлектрическому состоянию, называется [c.262]Поскольку молекулы белка имеют суммарные электрические заряды, удаленные от изоэлектрической точки, они движутся в растворе, когда к нему приложено электрическое поле. Если в процессе участвуют коллоиды или макромолекулы, он называется электрофорезом. Ионная подвижность и, которую рассчитывают как и для других ионов (разд. 11.5), зависит от суммарного заряда и коэффициента трения. [c.603]
В кислой среде, когда в результате избытка водородных ионов подавлена ионизация карбоксильных групп, молекула белка ведет себя как основание, приобретает положительный заряд и при электрофорезе движется к катоду. В щелочной среде, наоборот, подавлена ионизация аминогрупп, и молекула белка ведет себя как кислота и при электрофорезе передвигается к аноду.В изоэлектрической точке суммарный заряд частицы равен нулю, т. е. отрицательный заряд всех находящихся на частице анионных групп точно скомпенсирован положительным зарядом катионных групп. [c.355]
Тот факт, что белки являются многовалентными кислотами и основаниями, определяет важное свойство их структуры. Значения рК кислотных групп в белках приведены в табл. 20,1. Значение р/С данной группы в белке меняется в широком диапазоне из-за влияния соседних частей белка, а также из-за электростатического действия зарядов на остаток молекулы белка. Если суммарный заряд молекулы белка положителен, как это имеет место в ряде кислотных растворов, то протону легче выйти из кислотной группы, и значения р/С понижаются. Если же суммарный заряд отрицателен, как в случае некоторых щелочных растворов, то протону труднее выйти из кислотной группы, и значения рК повышаются. Вследствие этого кривая титрования белка может быть более крутой, чем кривые титрования аминокислотных цепей. На каждом конце полипептидной цепи будет находиться а-карбоксильная или а-ами-ногруппа. Добавочные электрические заряды — это результат связывания ионов белком. В изоэлектрической точке число положительных зарядов равно числу отрицательных зарядов, так что в приложенном электрическом поле белок не движется. [c.602]
При определенном pH среды молекула белка несет суммарный электрический заряд, равный нулю. Такое значение pH раствора называется изоэлектрической Шоч-кой. Растворы белков в р/ наименее устойчивы и белки легко выпадают в осадок. Вследствие этого определение р/ белка может быть сведено к определению pH раствора, при котором наблюдается наибольшее помутнение раствора белка. [c.31]
Амфолитная природа белка базируется иа количестве кислых и основных групп в боковых цепях и их распределении, так как в общем случае концевые амиио- и карбоксильные группы вносят очень малый вклад в суммарный заряд молекулы. [c.356]
Электростатическое взаимодействие между белком и ионитом определяется количеством заряженных групп белка, его суммарным зарядом, дипольным моментом, ориентацией макромолекулы на поверхности сорбента, зарядом сорбента и другими факторами. Так как эти факторы для отдельных белков различны, то у них разная сорбируемость, на чем и основано их разделение. Сорбируемость белков наибольшая в бессолевой среде или в разбавленных буферных растворах. В присутствии солей сорбируемость снижается, ионы соли вытесняют ион белка или, взаимодействуя с ним, изменяют его электрический заряд. Интервал концентрации нейтральной соли, например ЫаС), в котором сорбируемость данного белка изменяется от минимальной до максимальной, называется интервалом перехода. Каждый белок [c.124]
Описание электрохимических свойств белков и- соответствующих аналитических методов — задача последующих разделов руководства. Там же излагается теория электрофореза белков. Здесь укажем лишь, что белки значительно отличаются друг от друга по подвижности в электрическом поле. Если pH раствора соответствует изоэлектрической точке данного белка, то суммарный заряд белка равен нулю, и электрическое поле не будет влиять на его движение. При снижении pH суммарный заряд становится положительным, и белок направляется к катоду. При pH, большем изоэлектрической точки, белок двигается к аноду. Скорость движения тем больше, чем больше pH раствора отличается от изоэлектрической точки данно- [c.29]
Значение pH раствора полиамфолита, при котором средний суммарный заряд на цепи равен нулю, называется изоэлектрической точкой (ИЭТ). Величина ИЭТ не зависит от концентрации полиамфолита и является важной константой полиамфолита. На различии в ИЭТ основано фракционирование смесей белков, например, методом электрофореза. При определении ИЭТ учитывается суммарный заряд макромолекул, обусловленный не только диссоциацией кислотных и основных групп полиамфолита, но и специфическим связыванием посторонних ионов из раствора. ИЭТ определяется с помощью электрокинетических методов (в частности, электрофореза) либо косвенным путем по изменению свойств, связанных с зарядом макромолекул. Значения степени набухания, растворимости полиамфолитов, осмотического давления и вязкости их растворов в ИЭТ проходят через минимум. Вязкость в ИЭТ минимальна (рис. IV. 7), поскольку вследствие взаимного притяжения присутствующих в равном количестве противоположно заряженных групп полимерная цепь принимает относительно свернутую конформацию. При удалении от ИЭТ цепь полиамфолита приобретает суммарный положительный (в кислой области pH) или отрицательный (в щелочной области pH) заряд [c.127]
В кислой среде, где концентрация водородных ионов преобладает над концентрацией гидроксильных ионов, I процесс, т. е. процесс диссоциации с отщеплением водородных ионов, ослабляется, а II процесс, т. е. процесс связывания водородных ионов, усиливается. При определенной кислотности раствора эти два процесса уравновешивают друг друга. В этом случае частицы белка связывают столько же водородных ионов, сколько и отщепляют их, поэтому количество положительных зарядов на поверхности частиц равно количеству отрицательных зарядов. Суммарный заряд частиц в этом случае равен нулю, т. е. система находится в изоэлектрическом состоянии. [c.224]
Метод используется для разделения белков по суммарному заряду. [c.342]
Суммарный электрический заряд белка, т. е. алгебраическая сумма элементарных зарядов, варьирует особенно в зависимости от pH и концентрации ионов. [c.77]
Если внести в электрофоретическую кювету раствор, содержащий различные белки, и приложить электрическое напряжение, то скорость движения каждого белка будет зависеть от плотности заряда, которая определяется как суммарный заряд частицы на единицу площади поверхности. В идеальном случае каждый индивидуальный белок будет двигаться со скоростью, отличной от скорости движения остальных белков. Поэтому при достаточных размерах кюветы и за достаточно большое время смесь белков разделится на индивидуальные компоненты. Секции кюветы можно отделить друг от друга так, чтобы в каждую попал индивидуальный белок. Таким образом, электрофоретическая техника может быть использована для получения чистых белков. [c.354]
Электрофорез в присутствии додецилсульфата натрия (ДДС-N3). В этой системе суммарный заряд белка маскируется добавлением ДДС-Ыа, который окутывает белки облаком отрицательных зарядов. Предполагается, что все комплексы ДДС-белков имеют заряды одинаковой плотности, процесс разделения происходит только по одному параметру — размеру молекулы. Эта система позволяет в то же время определять молекулярную массу изучаемых белков с помощью маркеров — набора белков с заранее известными значениями молекулярной массы. [c.40]
Законы электростатики были с успехом использованы также при интерпретации кривых титрования белков, суммарный отрицательный или положительный заряд поверхности которых непрерывно меняется по мере роста числа присоединившихся протонов при переходе от высоких значений pH к низким [17]. [c.260]
Принцип и ограничения метода. Техника электрофореза основана на принципе дифференциальной подвижности белковых молекул в поддерживающей среде, или носителе (крахмал, полиакриламид, ацетат целлюлозы и др.), под действием электрического тока. Подвижность есть функция суммарного электрического заряда молекулы, который зависит от ионизации аминокислот белка и отсюда — от pH, а также от размеров молекулы белка. [c.39]
Белки являются полиамфолитами, т. е. они содержат как положительно, так и отрицательно заряженные ионогенные группы. Для всех полиамфолитов характерна зависимость их заряда от pH при низких pH они заряжены положительно, при высоких — отрицательно. Для каждого белка существуют такие значения рР1, при которых суммарный заряд молекулы равен нулю. Это значение pH определяется как изоэлектрическая точка. Очевидно, что изоэлектрическая точка полипептидной цепи определяется природой входящих в нее аминокислотных звеньев (см. табл. 6.7). Следует подчеркнуть, что все функции белков реализуются только в присутствии воды, т. е. в растворе или в набухшем состоянии. [c.340]
Электрофокусирование. В отличие от описанных методов, при которых работают с постоянным pH, здесь электрофорез осуществляется в градиенте pH на основе амфотерных молекул (коммерческие препараты) или уже фиксированных (иммобилизованных), добавляемых в акриламидный гель. В этих условиях белки мигрируют до тех пор, пока не достигнут зоны pH геля, которая соответствует их изоэлектрической точке рН1 (или в этом случае их суммарный заряд равен нулю). Каждая из фракций фокусируется в очень тонкие полосы, что обеспечивает разрешение, обычно недостижимое при других методах. [c.40]
Наоборот, когда суммарный заряд белка равен нулю, т. е. когда pH равен изоэлектрической точке белка, белки стремятся объединяться и формировать частицы, которые задерживаются при фильтрации. [c.416]
В то время как амины и аминокислоты, несущие положительный заряд, более прочно удерживаются при более высоких значениях pH, для отрицательно заряженных сорбатов справедливо обратное. Систематические исследования, проведенные на серии N-бензоил-о, L-аминокислот, позволили глубже понять механизм взаимодействия сорбата с белком. Влияние изменения свойств подвижной фазы на величины к VI а демонстрирует рис. 7.10. Во-первых, удерживание в значительной степени возрастает с усилением гидрофобного характера аминокислоты (Ser > А1а> Phe). Во-вторых, увеличение суммарного отрицательного заряда белка с увеличением pH вызывает уменьшение к для всех шести соединений (вследствие ионного взаимодействия). Далее, влияние концентрации буфера можно объяснить усилением адсорбции вследствие ионных взаимодействий при низкой ионной силе. Небольшое, но вполне заметное возрастание к для наиболее сильно удерживаемых сорбатов при высоких концентрациях буфера вероятнее всего является результатом усиления гидрофобных взаимодействий. Поскольку ионные (кулоновские) и гидрофобные взаимодействия по-разному подвержены влиянию ионной силы, то оба эффекта приводят к возникновению минимума в адсорбции сорбата (к ) в определенной точке. И наконец, совершенно очевидно влияние органического растворителя-модификатора он всегда приводит к понижению удерживания сорбата и тем сильнее, чем более гидрофобен сорбат. Влияние pH и ионной силы на удерживание незаряженных соединений невелико, но выражено вполне отчетливо. Оно связано исключительно с изменениями в связывающем центре ХНФ. Добавление пропанола-1 вызывает уменьшение удерживания по сравнению с наблюдаемым у заряженных сорбатов, что свидетельствует о преимущественном вкладе в удерживание гидрофобных взаимодействий. Это подтверждает также наблюдаемое очень большое влияние на удерживание длины цепи алканола-1. Высшие спирты являются значительно более эффективными конкурентами за связывающий центр, а потому вызывают более быстрое элюирование сорбата. Возможность регулирования удерживания путем изменения подвижной фазы, которую демонстрирует схема 7.6, говорит о том, что эту особенность данных хроматографических систем можно использовать в целях оптимизации разделения. [c.135]
Таким образом, если смесь белков поместить в электрическое поле, то белки с суммарным отрицательным зарядом будут передвигаться по направлению к аноду, белки с положительным зарядом — к катоду, а белки, находящиеся в изоэлектрической точке (т. е. с нулевым суммарным зарядом), останутся на месте. Разделение такой смеси можно проводить на фильтровальной бумаге, пропитанной буфером, на забуференных крахмальных колонках или в усовершенствованном аппарате для электрофореза, сконструированном Тизелиусом. Для подробного ознакомления с принципами, положенными в основу использования аппарата Тизелиуса, рекомендуем две статьи Олберти [ 1 ]. [c.16]
Белки представляют собой многовалентные амфотерные вещества, содержащие положительно и отрицательно заряженные пруппы, число которых в каждом отдельном случае характерным образом изменяется в зависимости от -величины рН. В отсутствие соли растворимость белка обычно является наименьшей при изоионном значении рН белка, когда суммарный заряд равен нулю, и увеличивается при повышении и понижении рН. На рис. 4 показано влияние изменения величины рН и иоиной силы яа растворимость -лактоглобулина [199]. Нижияя кривая (/) соответствует ионной силе, равной 0,001 в отсутствие соли удовлетворительные результаты не удается получить вследствие экспериментальных затруднений, [c.44]
ПОЛИИОН представляет гидродинамически непроницаемый клубок, все ионы, расположенные внутри клубка, будут уноситься с ним без какого либо дополнительного рассеяния энергии в результате внутреннего трения. С другой стороны, противоионы, расположенные снаружи клубка (или снаружи частицы глобулярного белка, несущей суммарный электрический заряд), будут вносить сравнительно большой вклад в коэффициент трения иолиэлектролита и таким образом приводить к заметному уменьшению скорости седиментации. Следует отметить, что этот эффект должен уменьшаться с увеличением концентрации соли, так как полимерный клубок с ионами, расположенными внутри него, в большей или меньшей степени становится доннановской системой с суммарным зарядом, приближающимся к нулю. [c.308]
Подвижность при нулевой концентрации геля должна отвечать истинной электрофоретической подвижности ДСН-белковых комплексов, на которой не сказываются никакие взаимодействия с гелем. Упрощенной теории электрофореза, кратко изложенной выше, достаточно, чтобы мы могли понять, почему и(0) — величина постоянная. Если в ДСН-белковых комплексах весовое содержание ДСН сохраняется на постоянном уровне и можно пренебречь зарадом самого белка, то суммарный заряд Z комплекса прямо пропорционален молекулярной массе и тем самым длине / комплекса, так как последний имеет форму стержня. Коэффициент трения также приблизительно пропорционален массе молекулы это видно из формулы / = бтгг/y pF. Для стержнеобразной молекулы объем гидратированной формы прямо пропорционален ее длине. Фактор формы F можно оценить с помощью уравнения (10.19а) для вытянутых эллипсоидов. При очень больших значениях f In (a/b). Ho отношение осей в случае стержня просто пропорционально [c.304]
Зависимость суммарного заряда на полипептиде или белке от изменения pH среды можно использовать для разделения этих молекул с помощью электрофореза. Если смесь полипептидов в водном буферном растворе с известным значением pH подвергнуть воздействии сильного электрического поля, то молекулы с общим положительным или отрицательным зарядом будут перемен аться в противоположных направлениях, в то время как молекулы с нулевым зарядом при выбранном pH останутся ненодвижными. Сложную смесь белков можно раз-де. шть на компоненты, осуществляя электрофорез па бумаге, пропитанной буфером, или в гель-нроводящей пленке. Подвижность состав[1ых частей смеси или паправлспие их перемещения П[)и э. ектрофорезе зависят от значения pH, при котором проводится процесс. [c.300]
В принципе точно такая же ситуация имеет место и в случае амфолитов, например белков. Разница лишь в том, что вместо двух зарядов противоположного знака суммарный электрический заряд макромолекулы определяется совокупностью множества положительных зарядов (у белка — за счет остатков Lys, Arg и His) и мпозкества отрицательных (за 4UT остатков Asp и Glu). Существенно отметить, во-первых, что как при pH — р1, так и при любых других уиаченнях pH в огромной популяции молекул амфолитов имеются как в целом нейтральные, так и суммарно положительно и отрицательно заряженные молекулы (с изменением pH изменяются лишь их пропорции), [c.259]
Обычно для обеспечения эффективной сорбции белка на ионооб-меинике и одновременно снижения опасности многоточечной сорбции белка прп низкой концентрации соли ( противоположный знаку зарядов сорбента. [c.265]
Электрические заряды этих частиц и молекул создаются ионизированными группировками боковых цепей аминокислот, производных моносахаридов (уроновые кислоты, аминосаха-ра [92]), полярными группировками некоторых мембранных липидов (фосфолипиды и сульфолипиды хлоропластов). Отметим, однако, что мембраны хлоропластов гороха (ламеллы и оболочки) лишены гликопротеинов [54]. Электрические заряды повышают растворимость, когда значение pH отдалено от изоэлектрической точки частиц, создавая силы отталкивания между частицами одинакового знака электрического заряда. Наоборот, вблизи изоэлектрической точки суммарный заряд частиц равен нулю агрегация их облегчена. Так, изоэлектрическая точка рибулозобисфосфаткарбоксилазы/оксигеназы нескольких видов растений находится в диапазоне pH 4,4 и pH 4,7 [4], и вследствие этого все белые протеины осаждаются практически спонтанно при этих pH [60]. Точно так же поликатионные агенты, которые образуют мостики между частицами с отрицательными зарядами, благоприятствуют флокуляции (коагулированию) белков зеленого клеточного сока при изоэлектрической точке растворимых белков [2] либо осаждению зеленых белков посредством термокоагуляции [61]. Однако термокоагуляция обусловливается в первую очередь не ионными взаимодействиями, а перераспределением гидрофобных взаимодействий. [c.246]
Далее следует сделать выбор между аниона- и катионообменни-ком. При фракционировании определенным образом заряженных молекул такой выбор не представляет труда. Например, очевидно, что олигонуклеотиды следует делить на анионообменнике, а заведомо щелочные белки, например гистоны,— на катпонообменнике. Для амфотерных молекул посредством выбора pH буфера можно задавать знак суммарного заряда и таким образом определять нужный тип ионообменника. Здесь решающим соображением может оказаться учет диапазона pH, в котором препарат (например, белок) сохраняет свою нативность, не склонен к агрегации или неспецифической сорбции. Если такой диапазон pH располагается по обе стороны от изоэлектрической точки очищаемого компонента исходной смеси, то выбор типа обменника может диктоваться оптимизацией условий разделения, как было пояснено выше, в разделе Хроматографический процесс . [c.287]
Гистон НЗ из тимуса теленка содержит 135 аминокислотных остатков [288], причем суммарный заряд первых 53 из них составляет -М8. Возможно, именно эта часть белка связывается с ДНК. В то же время карбоксильный конец этого гистона обладает гидрофобными свойствами и лишь в незначительной степени — основными. Интересные кластеры основных аминокислот были обнаружены в отдельных участках полипептидной цепи гистона Н2а [289]. Одна из любопытных особенностей строения гистонов — это наличие большого числа микромодификаций, сводящихся к фосфорилированию остатков серина, ацетилированию и метилированию остатков лизина, а также метилированию боковых цепей аргинина. Так, например, остатки Ьуз-14 и Ьуз-23 в гистоне НЗ К-ацетилированы, тогда как остатки Ьуз-9 и Ьуз-27 частично 8-Ы-метилированы — каждый участок содержит частично моно-, частично ди- и частично триметильные производные. [c.302]
Изоэлектрическое фокусирование [42 — 45] в линейном градиенте pH позволяет разделить белки, характеризующиеся различными изоэлектрическими точками. Для создания градиента используют носители с цвнттер-ионными свойствами — алифатические полиаминополикарбоновые кислоты, имеющие М 200 — 700. При движении в градиенте pH суммарный заряд белка постоянно меняется, и в области pH, близких к изоэлектрической точке, становится равным нулю. Соответствующий белок фокусируется , образуя узкую зону. При препаративном фокусировании в колонке стабилизация градиента pH осуществляется с помощью градиента плотности используемого буферного раствора, однако чаще работают с плоскими слоями полиакриламидного или гранулированного геля. Опубликовано краткое сообщение о непрерьтном электрофокусировании без носителя [46]. Эффективность электрофокусирования высока. Так, возможно, например, разделить белки, различающиеся по ИЭТ лишь на 0,01 единицы pH. При разделении сыворотки образуется более 40 белковых полос. [c.351]
В изоэлектрической точке белковая молекула представляет собой цвиттер-иои, т. е. положительные и отрицательные заряды в молекуле взаимно уравновешиваются и суммарный заряд молекулы равен нулю растворимость и гидратация минимальны, отсутствует движение в электрическом поле. Изоэлектрическая точка может быть определена из кривой титрования, отражающей суммарное состояние ионизации молекулы. В случае глобулярных белков ионизируемые группы преимущественно локализова-, ны иа поверхности молекулы. Группы, находящиеся внутри или принимаю- щие участие в образовании водородных связей, могут быть зарегистрированы титрованием после денатурации. Кроме того, изоэлектрическая точка( может быть установлена путем определения минимума растворимости й [c.356]
В расчете БПТИ учитывались внутримолекулярные ван-дер-ваальсовы электростатические и торсионные взаимодействия, а также водородные связи. Каковы же вклады этих взаимодействий в энергию нативной конформации белка Аминокислотная последовательность БПТИ включает 18 остатков, несущих 12 положительных и 13 отрицательных целочисленных зарядов. Стабилизирующий вклад электростатических взаимодействий заряженных остатков составляет около -50 ккал/моль, а дестабилизирующий — -1-35 ккал/моль. Следовательно, хотя электростатические взаимодействия и понижают конформационную энергию приблизительно на 15 ккал/моль, их интегральный вклад в стабилизацию структуры БПТИ невелик (5%). Суммарный стабилизирующий эффект водородных связей составил около -14 ккал/моль, т.е. расчете водородные связи обусловлены сложным комплексом многих межостаточных взаимодействий, среди которых собственно водородные связи играют незначительную роль. Общая энергия торсионных взаимодействий в найденной конформации БПТИ равна около -1-58 ккал/моль, те -10 ккал/моль на остаток. Из этого следует, что взаимные расположения практически всех атомных групп основных и боковых цепей аминокислотных остатков отвечают минимумам торсионных потенциалов. Таким образом, доминирующий вклад (75%) в конформационную энергию межостаточных взаимодействий белка вносят ван-дер-ваальсовы, точнее, дисперсионные контакты. [c.468]
Другим примером миграции ацильной группы от N к О под влиянием безводного к-ислотного реагента Является обратимое инактивирование лизоцима безводной муравьиной кислотой прн комнатной температуре [167]. В этом случае ход перегруппировки контролировался путем определения содержания аминного азота и измерения активности фермента. Полное инактивирование наступало через 16 час. Помимо увеличения содержания аминного азота изменение белка выразилось также в появлении повышенного суммарного положительного заряда, что сказалось на подвижности молекулы белка при ионофорезе. В водной среде при pH 8,5 происходили Обратные изменения при pH 7,5 обращение было нет полным, если судить по ионофорезу и поглощению щелочи, [c.223]
Многофункциональный белок — обзор
Общее описание цитокинов
Цитокины — это многофункциональные белки, часто называемые «гормонами иммунной системы». В отличие от классических гормонов, цитокины вырабатываются различными типами клеток в ответ на несколько типов стимулов, и они обладают перекрывающейся биологической активностью. 1–4 Цитокины — мощные эндогенные медиаторы, синтез и секреция которых находятся под жестким регуляторным контролем. Эти эндогенные медиаторы не хранятся в виде предварительно сформированных молекул в клетках-продуцентах; скорее, для секреции требуется новый синтез.После высвобождения их период полураспада относительно короткий, что еще больше ограничивает биологическую активность. Цитокины действуют в незначительных количествах (от 10 -9 до 10 -12 моль) путем связывания со специфическими клеточными рецепторами, которые являются членами различных структурных семейств. Большинство клеточных ответов на цитокины приводят к измененному паттерну экспрессии генов, что приводит к изменениям клеточной физиологии.
Важной функцией цитокинов является межклеточная связь. Цитокины необычны тем, что они могут связываться аутокринным, паракринным или эндокринным образом. 3,4 Большинство действий цитокинов происходит на локальном уровне, где цитокины действуют паракринным образом путем простой диффузии или межклеточного контакта. Некоторые клетки-продуценты цитокинов также экспрессируют рецепторы цитокинов, а секретируемые цитокины могут связываться с клетками-продуцентами и модулировать функцию клеток. Цитокины также могут покидать местную среду, попадать в кровоток, взаимодействовать с различными системами органов и изменять физиологию хозяина.
Группа цитокинов вырабатывается в ответ на воспалительные стимулы.Функция этих провоспалительных цитокинов заключается в передаче окружающим тканям информации о наличии инфекции или травмы. 2,4 Основными провоспалительными цитокинами являются фактор некроза опухоли-α (TNF-α), интерлейкин-1 (IL-1), IL-6, IL-8, IL-12, IL-18 и интерферон-γ ( IFN-γ). TNF и IL-1 являются основными медиаторами воспалительного ответа и, как полагают, играют решающую роль в организации местного ответа через активацию клеток и запуск цитокинового каскада. 5 Провоспалительные цитокины могут также проникать в системный кровоток и вызывать активацию иммунных клеток и значительные изменения в физиологии хозяина, такие как лихорадка и реакция острой фазы. 5 Воспалительные стимулы также запускают синтез противовоспалительных цитокинов и специфических ингибиторов цитокинов, которые служат для модификации воспалительной реакции хозяина. 6–8 Противовоспалительные цитокины ограничивают воспалительную реакцию, подавляя синтез провоспалительных цитокинов; Ключевые противовоспалительные цитокины включают IL-10, IL-13, IL-4 и IL-11.Встречающиеся в природе ингибиторы провоспалительных цитокинов нейтрализуют биоактивность провоспалительных цитокинов, блокируя взаимодействия цитокин-цитокиновый рецептор, связываясь либо с самим провоспалительным цитокином, либо с его специфическим рецептором. Встречающиеся в природе ингибиторы включают растворимые рецепторы провоспалительных цитокинов, рецепторы-ловушки, антагонисты рецепторов и связывающие цитокины белки. Взаимодействие между этими провоспалительными цитокинами, противовоспалительными цитокинами и природными ингибиторами цитокинов определяет воспалительный ответ и его эффективность.
Многофункциональные белки (молекулярная биология)
Многофункциональные белки объединяют несколько автономных функций в одной полипептидной цепи. В этом смысле автономия подразумевает, что каждая функция назначена разному участку или домену полипептидной цепи. Многофункциональные белки контрастируют с мультиферментными комплексами, в которых разные полипептиды нековалентно связаны. Определение исключает ферменты, которые катализируют разные реакции с использованием одного и того же активного центра, такие как аспарагиназа, функционирующая как глутаминаза, фосфоглицеромутаза, которая может катализировать три разные реакции с использованием одного и того же реакционного центра, или цистатионин-g-синтаза, которая может катализировать целый ряд аналогичных реакции из-за его относительной недостаточности субстратной специфичности.Аллостерические ферменты не считаются многофункциональными. Несмотря на то, что они обладают сайтами связывания эффекторных лигандов (ингибиторов или активаторов), расположенных в разных областях полипептидной цепи, они определены только в отношении каталитической функции.
Многофункциональные белки обычно имеют разные каталитические функции, находящиеся в отдельных доменах одной и той же полипептидной цепи. Несколькими примерами Escherichia coli являются ДНК-полимераза I, фосфорибозилантранилатизомераза-индолеглицеролфосфат-синтетаза ((1), (2)) (см. TRP-оперон), аспартат-киназы-гомосерин-дегидрогеназы ((3), (4)) и хоризмат-мутаза- префенатдегидрогеназа ((5), (6)).У Neurospora crassa две функции триптофансинтазы (см. TRP Operon), а именно расщепление индолеглицеринфосфата и комбинация индола с серином, находятся в одной и той же полипептидной цепи, тогда как в E. coli каждая из них осуществляется независимой цепью, нековалентно связан с другим. В этом случае фермент E. coli является не многофункциональным белком, а мультиферментным комплексом ((7), (8)).
Другими примерами являются флавоцитохром b2 Saccharomyces cerevisiae (9), гомотетрамер, который одновременно является l-лактат-цитохром с-оксидоредуктазой (флавопротеином) и цитохромом b 2.
1. Более двух каталитических функций могут быть объединены в одной полипептидной цепи
ДНК-полимераза I из E. coli представляет собой мономер, наделенный тремя активностями: ДНК-полимераза, 5′-3′-экзонуклеаза и 3′-5′-экзонуклеаза (10). Карбамилфосфатсинтетаза из клеток асцитной гепатомы представляет собой гомотетрамер, также наделенный активностью аспартат-транскарбамоилазы (в E. coli эта активность осуществляется независимыми белками) ((11), (12)). У N. crassa одна полипептидная цепь, организованная как гомодимер, отвечает за пять биохимических реакций, ведущих к биосинтезу ароматического кольца (13).b6) состоит из двух многофункциональных белков. Один из полипептидов несет активность малонилтрансацетилазы, b-гидроксиацилдегидразы, еноилредуктазы и пальмитилдеацилазы, тогда как другая полипептидная цепь несет активность b-кетоацилсинтазы, b-кетоацилредуктазы и белка-ацил-носителя. В сочетании с ацетилСоА-карбоксилазой комплекс катализирует конденсацию ацетильных субъединиц с образованием конечного продукта — пальмитиновой кислоты (14). Синтетаза жирных кислот птиц, которая несет ту же серию реакций, представляет собой гомодимер, организованный по принципу «голова к хвосту».Каждый из идентичных полипептидов несет в себе все вышеупомянутые ферменты (15).
2. Каталитические и некаталитические функции могут быть объединены.
В случае цитохрома b 2 из микросом печени теленка, один домен белка представляет собой собственно цитохром b2, тогда как другой домен отвечает за якорную функцию (16). Гомодимерный меромиозин млекопитающих имеет домен, наделенный АТФазной активностью, тогда как другой домен выполняет структурную функцию (формирование толстых филаментов) (17).Токсин дифтерии представляет собой мономер, аминоконцевая часть которого рибозилирует фактор элонгации млекопитающих, тогда как С-концевая часть отвечает за транспортировку каталитической части через мембрану (18). Репрессор биотина — очень интересный бифункциональный белок из 321 аминокислотного остатка, который действует на двух разных уровнях. Помимо репрессорной функции, он наделен холоферментсинтетазной активностью ацетил-КоА-карбоксилазы (19).
3. Некаталитические функции могут быть объединены
Альбумины сыворотки крови человека и крупного рогатого скота состоят из трех гомологичных доменов.Они наделены независимыми связывающими и транспортными функциями для триптофана, билирубина и длинноцепочечных жирных кислот (20). Репрессор Lac, гомотетрамер, имеет два независимых домена: небольшой N-концевой домен, который распознает соответствующую операторную ДНК, и ядро, которое связывает индуктор. Аминоконцевая часть конститутивного мономера обеспечивает сборку в тетрамеры (21). Другие репрессоры также имеют отдельные домены для связывания лиганда и для специфического связывания ДНК. Иммуноглобулины млекопитающих имеют отдельные сайты связывания антигена и связывания комплемента (22).
4. Структурные доказательства многофункционального белка
1. В одной полипептидной цепи должно быть более одной функции.
2. Автономность этих функций должна быть продемонстрирована существованием отдельных доменов в этой полипептидной цепи. Генетический анализ может предоставить доказательства того, что можно выделить мутанты, которые имеют дефект только в одной функции. Одноточечные мутации могут привести к потере более чем одной функции.Однако в этом случае следует исключить плейотропные эффекты. Убедительные доказательства могут быть получены путем построения подробной генетической карты, как это сделано для нескольких ферментов из E. coli ((23), (24)).
3. Убедительным доказательством является выделение и определение характеристик фрагментов, которые сохранили свою индивидуальную функцию без нарушения. N-концевой домен может быть получен и выделен с использованием бессмысленных мутантов. Ограниченный протеолиз также полезен, потому что шарнирный пептид, который связывает отдельные домены, часто очень чувствителен к протеолитической атаке (25).
4. Химическая модификация может повлиять на одну функцию, не затрагивая другую. Например, активность аспартаткиназы I E. coli разрушается при обработке фермента сульфгидрильными реагентами, тогда как другая каталитическая активность бифункционального белка, гомосериндегидрогеназы, остается неизменной (26).
Подходящими физическими методами являются ультрацентрифугирование , гель-фильтрация и ПААГ с денатурирующими агентами и без них для определения молекулярной массы нативного белка и количества его субъединиц.Изоэлектрическая фокусировка может косвенно свидетельствовать об идентичности субъединиц. Количество автономных функций должно превышать количество отделяемых белковых полос. Полоса белка должна быть однородной. Окончательное доказательство, очевидно, обеспечивается общей последовательностью белка или кодирующего гена (кДНК в случае эукариот).
(PDF) Многофункциональные белки: примеры совместного использования генов
6. Ватанабе Х., Такехана К., Дэйт М., Шинозаки Т., Раз А.
Фактор аутокринной подвижности опухолевых клеток представляет собой полипептид нейролейкин /
изомеразы фосфогексозы.Cancer Res 1996; 56:
2960 ± 3.
7. Сюй В., Сейтер К., Фельдман Э., Ахмед Т., Чиао Дж. В.. Медиатор дифференцировки и созревания
для миелоидных клеток человека
лейкозных клеток имеет гомологию с нейролейкином или фос-
-изомеразой глюкозы. Blood 1996; 87: 4502 ± 6.
8. Lay AJ, Jiang XM, Kisker O, Flynn E, Underwood A,
Condron R, et al. Киназа фосфоглицеразы действует в ангиогенезе опухоли
как дисульфидредуктаза. Nature 2000; 408: 869 ±
73.
9. Фурукава Т., Йошимура А., Сумизава Т., Харагути М.,
Акияма С., Фукуи К. и др. Ангиогенный фактор. Nature 1992;
356: 668.
10. Soker S, Takashima S, Miao HQ, Neufeld G, Klagsbrun M.
Нейропилин-1 экспрессируется эндотелиальными и опухолевыми клетками как рецептор
, специфичный для изоформы эндотелия сосудов. рост
фактор. Cell 1998; 92: 735 ± 45.
11. Meyer-Siegler K, Mauro DJ, Seal G, Wurzer J, deRiel JK,
Sirover MA.Ядерная урацил-ДНК-гликозилаза человека представляет собой субъединицу массой 37 кДа
глицеральдегид-3-фосфатдегидроген-
азы. Proc Natl Acad Sci USA 1991; 88: 8460 ± 4.
12. Каскальо М., Вонг Дж., Стейнберг С., Вабл М. Исправление несоответствий
кооптировано гипермутацией. Science 1998; 279: 1207 ± 10.
13. Янг Д.Д., Лоуренс А.Дж., Маклин А.Г., Леунг Б.П., Макиннес
И.Б., Канас Б. и др. Сульфоксид тимозина бета 4 является противовоспалительным агентом
, вырабатываемым моноцитами в присутствии
глюкокортикоидов.Nat Med 1999; 5: 1424 ± 7.
14. Brix K, Summa W, Lottspeich F, Herzog V. Внеклеточно встречающийся гистон h2
опосредует связывание тиреоглобулина с
клеточной поверхностью макрофагов мыши. J Clin Invest 1998; 102:
283 ± 93.
15. Дарвиче Н., Фриман Л.А., Струнников А. Характеристика
компонентов предполагаемого комплекса когезии сестринской хроматиды
млекопитающих. Gene 1999; 233: 39 ± 47.
16. Ву Р.Р., Каучман-младший.кДНК клонирования базального белка
мембранный хондроитинсульфат протеогликановый коровый белок,
бамакан: структура домена ve, включая мотивы спиральной спирали.
J. Cell Biol 1997; 136: 433 ± 44.
17. Пико Д., Лолл П.Дж., Гаравито Р.М. Рентгеновская кристаллическая структура
мембранного белка простагландина h3-синтазы-1. Nature
1994; 367: 243 ± 9.
18. Thunnissen MMGM, Norlund P, Haeggstrom JZ. Структура кристалла
лейкотриен-А4 гидролазы человека, бифункционального фермента
в воспалении.Nat Struct Biol 2001; 8: 131 ± 5.
19. Citron BA, Davis MD, Milstien S, Gutierrez J, Mendel DB,
Crabtree GR, et al. Идентичность 4a-карбиноламиндегидратазы,
, компонента системы гидроксилирования фенилаланина, и
DCoH, трансрегулятора гомеодоменных белков. Proc Natl
Acad Sci USA 1992; 89: 11891 ± 4.
20. Guo GG, Gu M, Etlinger JD. 240-кДа ингибитор протеасомы
(CF-2) идентичен дегидратазе дельта-аминолевулиновой кислоты.J
Biol Chem 1994; 269: 12399 ± 402.
21. Suzuki CK, Rep M, van Dijl JM, Suda K, Grivell LA, Schatz
G. АТФ-зависимые протеазы, которые также являются шаперонным белком
биогенеза. Trends Biochem Sci 1997; 22: 118 ± 23.
22. Штаттс MJ, Канесса CM, Olsen JC, Hamrick M, Cohn JA,
Rossier BC, et al. CFTR как цАМФ-зависимый регулятор
натриевых каналов. Science 1995; 269: 847 ± 50.
23. Higgins, CF. Азбука канального регулирования.Cell 1995; 82:
693 ± 6.
24. Харди С.П., Гудфеллоу Х.Р., Вальверде М.А., Джилл Д.Р.,
Сепульведа В., Хиггинс С.Ф. Опосредованное протеинкиназой C фос-
форилирование человеческого гликопротеина с множественной лекарственной устойчивостью P-гликопротеин
регулирует хлоридные каналы, активируемые объемом клетки. EMBO J
1995; 14: 68 ± 75.
25. Лаки Д.Б., Кроуз М.Э., Харпер К.Л., Закон ТК, Вайн Дж.Дж.
Селекция на MDR1 / P-гликопротеин усиливает активированные набуханием токи K + и Cl- в клетках NIH / 3T3.Am J Physiol
1994; 267: C650 ± 8.
26. Джеффри CJ. Подрабатывающие белки. Trends Biochem Sci 1999;
24: 8 ± 11.
27. Чен Дж.В., Додиа К., Файнштейн С.И., Джайн М.К., Фишер А.Б. 1-Cys
пероксиредоксин, бифункциональный фермент с активностью глутатионпер-
оксидазы и фосфолипазы A2. J Biol Chem 2000;
275: 28421 ± 7.
28. Heikkinen J, Risteli M, Wang C, Latvala J, Rossi M,
Valtavaara M, et al. Лизилгидроксилаза 3 — это многофункциональный белок
, обладающий активностью коллагенглюкозилтрансферазы.J Biol
Chem 2000; 275: 36158 ± 63.
29. Креннелл С., Такимото Т., Портнер А., Тейлор Г. Кристалл
структура многофункциональной парамиксовируса hemaggluti-
нин-нейраминидазы. Nat Struct Biol 2000; 7: 1068 ± 74.
30. Низкий PS, Rathinavelu P, Harrison ML. Регулирование гликолиза
посредством обратимого связывания фермента с мембраной белка
, полоса 3. J Biol Chem 1993; 268: 14627 ± 31.
31. Шерсть, IG. Внерибосомные функции рибосомных белков.
Trends Biochem Sci 1996; 21: 164 ± 5.
32. Джеффри CJ, Bahnson BJ, Chien W, Ringe D, Petsko GA.
Кристаллическая структура кроличьей фосфоглюкозоизомеразы, гликолитического фермента
, который подрабатывает нейролейкином, аутокринным фактором подвижности
и медиатором дифференцировки. Биохимия
2000; 39: 955 ± 64.
33. Numata O. Многофункциональные белки в Tetrahymena: 14 нм
® ламентный белок / цитратсинтаза и удлинение трансляции
фактор-1 альфа.Int Rev Cytol 1996; 164: 1 ± 35.
34. Урсини Ф., Хейм С., Кисс М., Майорино М., Ровери А., Виссинг
Дж и др. Двойная функция селенопротеина PHGPx во время созревания сперматозоидов
. Science 1999; 285: 1393 ± 6.
35. Kennedy MC, Mende-Mueller L, Blondin GA, Beinert H.
Очистка и характеристика цитозольной аконитазы из
говяжьей печени и ее связь с железо-чувствительным элементом
, связывающим белок. Proc Natl Acad Sci USA 1992; 89: 11730 ± 4.
36. Mowbray SL, Koshland DE Jr. Мутации в рецепторе аспартата
Escherichia coli, которые влияют на связывание аспартата. J
Biol Chem 1990; 265: 15638 ± 43.
37. Вольф С., Паркинсон Дж. С.. Аспартатные такси мутанты хеморецептора tar
Escherichia coli. J Bacteriol 1988; 170:
4509 ± 15.
38. Чу Э., Келлер Д.М., Кейси Дж.Л., Дрейк Дж.С., Чабнер Б.А.,
Элвуд П.С. и др. Ауторегуляция трансляции информационной РНК тимидилат
-синтазы человека тимидилат-синтазой.
Proc Natl Acad Sci USA 1991; 88: 8977 ± 81.
39. Баркер Д.Ф., Кэмпбелл А.М. Генетическая и биохимическая характеристика гена birA и его продукта:
прямая роль холофермент-синтетазы биотина в репрессии оперона биотина
в Escherichia coli. J Mol Biol 1981; 146: 469 ± 92.
40. Муро-Пастор А.М., Островский П., Малой С. Регулирование экспрессии гена
путем локализации репрессора: биохимические доказательства того, что мембрана
и связывание ДНК белком PutA взаимно исключают друг друга.J Bacteriol 1997; 179: 2788 ± 91.
41. Островский де Спайсер П., Малой С. Белок PutA, мембранно-
-ассоциированная ¯avin-дегидрогеназа, действует как окислительно-восстановительный регулятор транскрипции
. Proc Natl Acad Sci USA, 1993; 90:
4295 ± 8.
42. Modun B, Morrissey J, Williams P. Стафилококковый рецептор трансферрина
: гликолитический фермент с новыми функциями.
Trends Microbiol 2000; 8: 231 ± 7.
43. Brew K, Vanaman TC, Hill RL.Роль альфа-лактал-
бумина и белка А в лактозосинтетазе: уникальный механизм
для контроля биологической реакции. Proc Natl
Acad Sci USA 1968; 59: 491 ± 7.
44. Tabor S, Huber HE, Richardson CC. Тиоредоксин Escherichia coli
придает процессивность ДНК-полимеразе
# 2003 Taylor & Francis. ISSN 0785-3890 Annals of Medicine 35
34 JEFFERY
| Функциональный ключ | Позиция (я) | Описание Действия | Графический вид | Длина | Этот подраздел PTM / Processing указано, что метионин инициатора отщепляется от зрелого белка. Инициатор метионин i | Удалено Подтвержденная вручную информация, полученная на основе экспериментальных и расчетных данных. Утверждение, сделанное вручную, выведено из комбинации экспериментальных и расчетных данных i
Ручное утверждение на основе эксперимента в i | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
В этом подразделе раздела «PTM / Обработка» описывается протяженность полипептидной цепи в зрелом белке после процессинга или протеолитического расщепления. Цепочка i PRO_0000075030 | 2 — 425 | Многофункциональный белок ADE2Add BLAST | 424 | ||||||||
| Функциональный ключ | Положение (я) | Описание Действия | вид | Длина | |||||||
В этом подразделе раздела «PTM / Обработка» указываются положение и тип каждого измененного остатка, за исключением lipids , гликаны и перекрестные ссылки протеина . Подробнее … Модифицированный остаток i | 2 | N-ацетилаланин Утверждение, сделанное вручную, выведенное из комбинации экспериментальных и расчетных данных i
Ручное утверждение на основе эксперимента в i | 1 | ||||||||
| Модифицированный остаток i | 22 | Фосфотирозин Информация, подобранная вручную, полученная на основе экспериментально охарактеризованного белка. Ручное утверждение, выведенное из сходства последовательностей с i | 1 | ||||||||
| Модифицированный остаток i | 27 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных данных 0008 7 Приведено для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБНЫЙ АНАЛИЗ] НА SER-27, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБ АНАЛИЗА]. Указано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ] НА SER-27, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ]. Указано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБНЫЙ АНАЛИЗ] НА SER-27 И THR-238, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБНЫЙ АНАЛИЗ]. Указано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ] НА SER-27 И SER-107, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБНЫЙ АНАЛИЗ]. Указано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ] НА SER-27, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ]. Указано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ] НА SER-27, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ]. Олсен Дж. В., Вермёлен М., Сантамария А., Кумар К., Миллер М.Л., Дженсен Л.Дж., Гнад Ф., Кокс Дж., Дженсен Т.С., Нигг Э.А., Брунак С., Манн М. Sci. Сигнал. 3: RA3-RA3 (2010) [PubMed] [Europe PMC] [Резюме] Цитируется для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБНЫЙ АНАЛИЗ] НА SER-27, ИДЕНТИФИКАЦИЯ МАССОВОЙ СПЕКТРОМЕТРИЕЙ [БОЛЬШОЙ МАСШТАБНЫЙ АНАЛИЗ]. Указано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ] НА SER-27, ИДЕНТИФИКАЦИЯ С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ [БОЛЬШОЙ МАСШТАБ АНАЛИЗ]. Процитировано для: ФОСФОРИЛИРОВАНИЕ [БОЛЬШОЙ МАСШТАБ АНАЛИЗА] НА SER-27; SER-107; THR-238 И SER-274, ИДЕНТИФИКАЦИЯ ПО МАСС-СПЕКТРОМЕТРИИ [МАСШТАБНЫЙ АНАЛИЗ]. | 1 | ||||||||
| Модифицированный остаток i | 36 | N6-ацетиллизин Ручное утверждение, выведенное из сходства последовательностей с i | 107 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
| 1 | ||||||
| Модифицированный остаток i | 238 | Phosphothreonine Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
| 1 | ||||||||
| Модифицированный остаток i | 247 | N6-acetyllysine Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i74 | остаток i | 274 | Фосфосерин Утверждение, сделанное вручную на основе комбинации экспериментальных и расчетных данных i
| 1 |
Многофункциональное семейство белков GIT
Резюме
Белки 1 и 2, взаимодействующие с G-белком-рецептором (GPCR) и киназой, взаимодействуют с повсеместно распространенными мультидоменными белками участвует в разнообразных клеточных процессах. Они перемещаются между тремя отдельными клеточными компартментами (цитоплазматическими комплексами, фокальными адгезиями и периферией клетки) посредством взаимодействия с белками, включая ARF, Rac1 и Cdc42 GTPases, p21-активированную киназу (PAK), PAK-взаимодействующий фактор обмена (PIX), киназу MEK1. , фосфолипаза Cγ (PLCγ) и паксиллин.GIT и PIX взаимодействуют с образованием больших олигомерных комплексов, в которые временно рекрутируются другие белки. Активация Rac1 и Cdc42 запускает ассоциацию PAK с этими олигомерами, что демаскирует сайт связывания paxillin в GITs, который рекрутирует их в фокальные комплексы. Там они регулируют динамику цитоскелета за счет ингибирования Rac1 по обратной связи. GIT также участвуют в интернализации рецепторов, регулируя мембранный перенос между плазматической мембраной и эндосомами, воздействуя на ARF GTPases за счет активности белка, активирующего ARF GTPase (ARF-GAP).Более того, GIT действуют как каркасы, контролирующие пространственную активацию нескольких сигнальных молекул. Наконец, недавние результаты предполагают патогенную роль белков ЖКТ в болезни Хантингтона и ВИЧ-инфекции.
Введение
Среди крупнейших семейств генов в геноме млекопитающих находятся рецепторы, связанные с G-белком (GPCR). Разнообразные нижестоящие сигнальные события, стимулируемые лигандами GPCR, требуют множественных сигнальных комплексов. Были идентифицированы многие взаимодействующие с GPCR белки, рекрутируемые во время инициации и терминации сигнала, такие как сами G-белки, аррестины и клатрин.Среди первых из этих белков, которые были обнаружены, были киназы GPCR (GRK), которые имеют решающее значение для фосфорилирования и интернализации рецепторов. Поиск белков, которые взаимодействуют с GRKs, привел к идентификации GRK-взаимодействующих белков (GIT), семейства каркасных белков (Premont et al., 1998). Было обнаружено, что ЖКТ почти одновременно связываются с белком фокальной адгезии паксиллином (Turner et al., 1999) и фосфолипазой Cγ (PLCγ) (Haendeler et al., 2000) (Таблица 1). Их называют «холод-ассоциированными фосфорилированными тирозином белками 1 и 2» [Cat-1 и Cat-2 (Bagrodia et al., 1999)], «фактор рибозилирования АДФ (ARF) -GTPase, активирующий белок, PIX-, белки, взаимодействующие с паксиллином 1 и 2» [APP-1 и APP-2 (Di Cesare et al., 2000)] и «p95 паксиллин киназный линкер ‘[(p95PKL) (Turner et al., 1999)], GIT1 и GIT2 — это названия, которые сейчас наиболее часто используются.
Таблица 1.Белки, взаимодействующие с ЖКТ
Белки GIT имеют сложную доменную структуру и, как теперь известно, связывают многие белки.Они, по-видимому, выполняют важные функции в контроле динамики цитоскелета и мембранного переноса между плазматической мембраной и рециркулирующими эндосомами. Здесь мы рассмотрим текущее понимание их структуры и функций.
Семейство GIT
Все млекопитающие и птицы, изученные на сегодняшний день, экспрессируют два белка GIT: GIT1 и GIT2. Белки GIT очень консервативны у млекопитающих и птиц. GIT1 идентичен на 98% у человека и мыши и на 85% — у человека и курицы.GIT2 на 86% идентичен у человека и мыши и на 89% идентичен у человека и курицы. Различия в последовательностях между ортологами возникают в основном в центральной области белков, что указывает на то, что консервативные N- и C-концы содержат важные функциональные домены.
GIT1 и GIT2 человека имеют 65% идентичности последовательностей и 85% сходства. Основное различие между этими белками состоит в том, что, в то время как GIT1 существует почти полностью в своей полноразмерной форме, GIT2 подвергается экстенсивному альтернативному сплайсингу тканеспецифичным образом.Он имеет по крайней мере десять различных вариантов сплайсинга и потенциально 32 различных транскрипта (Premont et al., 2000). Укороченная изоформа GIT2 создается путем включения альтернативного экзона, который содержит стоп-кодон и имеет отдельный 3′-нетранслируемый участок (Ohara et al., 1997). Мы называем эту «короткую GIT2» и более длинную изоформу «GIT2-long». GIT1 и GIT2 широко распространены. Самый высокий уровень наблюдается в семенниках и относительно мало — в печени и селезенке (Ohara et al., 1997; Paris et al., 2002; Premont et al., 1998; Premont et al., 2000). GIT2-long обнаружен во всех проанализированных тканях, тогда как GIT2-long, по-видимому, ограничен иммунными клетками (Premont et al., 2000).
Белки GIT образуют гомо- и гетеродимеры и локализуются в фокальных комплексах на периферии клетки, в очаговых адгезиях на вентральной поверхности клетки и в цитоплазматических структурах по всей клетке (Di Cesare et al., 2000; Loo et al., 2004 ; Manabe et al., 2002; Mazaki et al., 2001; Paris et al., 2002; Turner et al., 1999; West et al., 2001; Чжао и др., 2000). О присутствии GIT1 и GIT2 в центросомах также сообщалось недавно (Zhao et al., 2005). Сверхэкспрессируемый зеленый флуоресцентный белок (GFP), помеченный GIT1, частично совмещается с эндосомами, но не с маркерами компартмента Гольджи или мембран (Di Cesare et al., 2000; Manabe et al., 2002). Сообщалось, что GIT2-short локализуется на периферии клетки и в перинуклеарной области (Mazaki et al., 2001).
Структура домена белка GIT
Полноразмерные белки GIT имеют N-концевой ARF домен белка, активирующего GTPase (ARF-GAP), три анкириновых повтора (ANK), домен гомологии Spa2 (SHD), спиральный coil домен и сайт связывания паксиллина (PBS) (рис.1). Усеченный белок GIT2-short лишен домена спиральной спирали и PBS.
Домен ARF-GAP
ARF представляют собой небольшие GTP-связывающие белки, которые регулируют мембранный трафик, взаимодействуя с белками везикулярной оболочки и ферментами, метаболизирующими фосфолипиды. Они регулируются ARF-GAP, все из которых (включая GIT1 и GIT2) содержат мотив, похожий на цинковый палец (CX 2 CX 16 CX 2 C), необходимый для их активности GAP (Cukierman et al. , 1995; Goldberg, 1999).GIT1 и GIT2 проявляют активность ARF-GAP в отношении ARF1, ARF2, ARF3 и ARF5 in vitro (Mazaki et al., 2001; Premont et al., 1998; Premont et al., 2000; Premont and Vitale, 2001; Vitale et al. , 2000). В отличие от ARF-GAP, белки GIT также действуют на ARF6 (Uchida et al., 2001). Более того, их активность ARF-GAP стимулируется фосфатидилинозитол (3,4,5) -трисфосфатом [PtdIns (3,4,5) P 3 ], но не фосфатидилинозитол-5-фосфатом, фосфатидилинозитолом (4,5) -бисфосфат [PtdIns (4,5) P 2 ] или диацилглицерин (DAG) (Vitale et al., 2000). Следовательно, белки GIT могут рекрутироваться на плазматическую мембрану и активироваться в ответ на сигнальные события, регулируя сигнальный перенос через мембрану через ARF6.
Рис. 1.Доменная структура GIT1 и GIT2. Полноразмерные белки GIT имеют домен N-концевого ARF GTPase-активирующего белка (ARF-GAP), три анкириновых (ANK) повтора, домен гомологии Spa2 (SHD), домен спиральной спирали (CC) и паксиллин. -связывающий сайт (PBS). Укороченный белок GIT2-short лишен домена CC и PBS.
Удаление домена ARF-GAP или введение мутации R39K, которая отменяет активность ARF-GAP, приводит к тому, что GIT1 ассоциируется с очень большими рециркулирующими эндосомами, которые не наблюдаются в нормальных клетках (Di Cesare et al., 2000; Matafora et al. , 2001; Paris et al., 2002). Это открытие указывает на то, что активность ARF-GAP необходима для поддержания правильного мембранного транспорта и периферической локализации GIT1 (Matafora et al., 2001). Интересно, что большие везикулы, индуцированные сверхэкспрессией мутантов ARF-GAP GIT2, накапливают ранний эндосомный маркер EEA1, но не рециклирующий эндосомный маркер Rab11 (Paris et al., 2002). Таким образом, кажется, что GIT1 и GIT2 играют разные роли в торговле людьми.
Ankyrin повтора
Рядом с доменом ARF-GAP GIT1 и GIT2 находятся три повтора ANK. Повторы ANK обычно опосредуют белок-белковые взаимодействия, но не обладают согласованной последовательностью связывания и имеют различных партнеров по связыванию. Область, окружающая первый повтор ANK, имеет сходство последовательности с паксиллин-связывающей областью винкулина (Turner et al., 1999) и некоторое сродство к паксиллину в GIT2-коротком, но не в GIT1 и GIT2-длинном (см. Ниже) (Mazaki et al. ., 2001). Первый повтор ANK, по-видимому, опосредует связывание GIT с эндосомами, поскольку небольшие N-концевые фрагменты, включая только ARF-GAP и первый повтор ANK, локализуются в эндосомах, но удаление повтора ANK приводит к диффузной цитоплазматической локализации (Di Cesare et al. др., 2000; Париж и др., 2002).
Spa2-гомологичный домен (SHD)
SHD представляет собой тандемный повтор, присутствующий только в ортологах GIT1 и GIT2 и дрожжевых белках Spa2 и Sph2. Белки дрожжей необходимы для поддержания полярности клеток, локализуются в местах направленного роста клеток и необходимы для морфологических изменений во время спаривания дрожжей (Arkowitz and Lowe, 1997; Gehrung and Snyder, 1990; Snyder, 1989).Сложный набор белковых взаимодействий происходит на SHD с образованием большого олигомерного комплекса (Рис. 2). Основным партнером по связыванию этого домена является активированный p21 фактор обмена, взаимодействующий с киназой (PIX). Через PIX GIT могут также взаимодействовать с p21-активируемой киназой (PAK) и небольшими GTPases Rac1 и Cdc42.
PIX
Белки PIX содержат домены Dbl-гомологии и плекстрина (DH / PH), которые характерны для факторов обмена гуаниновых нуклеотидов (GEF). Они служат в качестве GEF для Rac2, Cdc42 и, в меньшей степени, для Rho (Feng et al., 2002; Loo et al., 2004; Manser et al., 1998). Два белка PIX называются α-PIX и β-PIX; последний альтернативно сплайсирован с формами 85 и 50 кДа. Только α-PIX и более длинная форма β-PIX связываются с GIT1. Α-спиральная область С-конца, по-видимому, обеспечивает связывание с SHD (Feng et al., 2002; Loo et al., 2004).
Белки GIT и PIX взаимодействуют через SHD в двухгибридных анализах (Premont et al., 2000) и в экспериментах по совместной иммунопреципитации (Bagrodia et al., 1999; Brown et al., 2002; Ди Чезаре и др., 2000; Ламорте и др., 2003; Loo et al., 2004; Премонт и др., 2000; Чжао и др., 2000). Поскольку оба белка могут гомодимеризоваться, они могут образовывать большие агрегаты в клетке (рис. 2). Действительно, GIT и PIX преимущественно обнаруживаются во фракциях с очень высокой молекулярной массой (1-2 МДа) в клеточных лизатах, разделенных гель-фильтрацией и градиентами плотности сахарозы (Paris et al., 2003; Premont et al., 2004). GIT и PIX, по-видимому, являются основными составляющими агрегатов и образуют комплексы аналогичного размера (приблизительно 10-25 субъединиц) при совместной экспрессии в клетках sf9 (Premont et al., 2004). Однако такие комплексы не могут быть созданы in vitro, это указывает на то, что они образуются ко-трансляционно (Premont et al., 2004).
Рис. 2.Сводная информация о взаимодействиях и функциях белков GIT1. Основные пути передачи сигналов включают (A) эндоцитоз агонистов (Ag) -рецепторов (GPCR); (B) стимулированная ангиотензином-II (AngII) активация PLCγ и мобилизация Ca 2+ ; (C) активация каркаса MEK1 в ответ на активацию TRK; (D) регуляция цитоскелета посредством PAK и GTPases семейства Rho; и (E) сборка и разборка фокального комплекса.G, гетеротримерные белки G; GRK, киназа GPCR; GPCR, рецептор, связанный с G-белком; IP 3 , инозитол (1,4,5) -трифосфат; Р — фосфорилирование; TKR, рецептор тирозинкиназы.
PIX и GITs совместно локализуются в фокальных комплексах, на периферии клеток и цитоплазматических комплексах, это указывает на то, что эти белки существуют как олигомеры в каждом из этих сайтов (Loo et al., 2004; Turner et al., 1999). Фактически, олигомеризация, по-видимому, важна для локализации в этих сайтах, поскольку мутации, которые нарушают либо ассоциацию GIT-PIX, либо гомодимеризацию PIX, приводят к диффузной цитоплазматической локализации обоих белков (Kim et al., 2001; Loo et al., 2004).
Малые GTPases
RhoA, Rac1 и Cdc42 играют важную роль в регуляции морфологии и подвижности клеток. Активность RhoA способствует сокращению актин-миозина, что приводит к образованию актиновых стрессовых волокон и устойчивых фокальных комплексов, называемых фокальными спайками. Активация Rac1 вызывает полимеризацию актина и образование ламеллиподий. Активация Cdc42 стимулирует образование филоподий. Rac1 и Cdc42, но не RhoA, связываются непосредственно с PAK в активном (GTP-связанном) состоянии, но не в неактивном (GDP-связанном) состоянии (Bagrodia et al., 1999). Первоначально считалось, что связанный с GTP Rac1 / Cdc42 непосредственно активирует активность киназы PAK. Однако недавние данные подтверждают важную роль комплексов GIT-PIX в Rac1 / Cdc42-опосредованной активации активности киназы PAK (Fig. 3). Эти новые данные указывают на то, что ассоциация с GTP-связанным Rac1 / Cdc42 вызывает конформационные изменения в PAK, которые раскрывают его N-концевую PIX-связывающую область, позволяя ассоциацию Rac1 / Cdc42-PAK с олигомерами GIT-PIX (Brown et al., 2002 ). Высокие локальные концентрации PAK в комплексах GIT-PIX допускают аутофосфорилирование и, следовательно, активацию PAK (Loo et al., 2004).
Rac1 / Cdc42-индуцированная ассоциация PAK с олигомерами GIT-PIX также рекрутирует GIT-PIX в фокальные комплексы. Транслокация GIT к периферии клеток ингибирует активность Rac1, таким образом действуя как отрицательная обратная связь, которая предотвращает пролонгированную активность Rac1 посредством неопределенного механизма, который требует активности ARF-GAP (Nishiya et al., 2005; West et al., 2001). Роль PIX и его потенциальная способность стимулировать Rac1 и Cdc42 за счет его доменов DH / PH изучены недостаточно.
Стимуляция эндотелиальных клеток тромбином привлекает GIT1 к фокальным адгезиям RhoA-зависимым образом (Shikata et al., 2003a; van Nieuw Amerongen et al., 2004), хотя конститутивно активный RhoA не индуцирует транслокацию GIT2 в очаговые спайки (Brown et al., 2002). Это предполагает существенное различие между GIT1 и GIT2, хотя причина этого несоответствия в настоящее время неизвестна. Поскольку RhoA не взаимодействует напрямую с PAK и не активирует его, его привлечение GIT1 к фокальным спайкам д. Происходить посредством механизма, отличного от того, с помощью которого Rac1 / Cdc42 индуцирует рекрутирование GITs в очаговые спайки.
Рис. 3.Rac1 / Cdc42-стимулированная активация PAK требует олигомеров GIT-PIX. Активированные Rac1 и Cdc42 взаимодействуют с неактивным PAK, вызывая конформационное изменение, которое позволяет ему связываться с олигомерами GIT-PIX посредством прямого взаимодействия с PIX. Высокие локальные концентрации PAK допускают аутофосфорилирование (P), стимулируя киназную активность PAK и его последующую диссоциацию от олигомеров GIT-PIX.
MEK1
MEK1 является вышестоящей киназой, которая фосфорилирует и активирует ERK1 / 2.GIT1 взаимодействует с MEK1 через SHD (Yin et al., 2004). Интересно, что область SHD дрожжевого Spa2 также взаимодействует с ортологами дрожжевого MEK1 (Mkk1p, Mkk2p и Ste7p), это указывает на то, что это эволюционно консервативная функция (Sheu et al., 1998). GIT1 может действовать как каркас, который осуществляет пространственный контроль активации ERK1 / 2, поскольку (1) GIT1 совместно локализуется с ERK1 / 2 в очаговых адгезиях (Yin et al., 2005), (2) сверхэкспрессия GIT1 продлевает рост эпидермального фактора роста (EGF). ) стимуляция ERK1 / 2 и (3) подавление экспрессии GIT1 с помощью короткой интерферирующей (si) РНК ингибирует EGF-стимулированную активность ERK1 / 2 (Yin et al., 2004).
PLCγ
PLCγ катализирует гидролиз PtdIns (4,5) P 2 в DAG и инозитол (1,4,5) -трифосфат [Ins (1,4,5) P 3 ], как и другие изоформы PLC, но однозначно регулируется фосфорилированием тирозина. GIT1 связывается с доменом PLCγ Sh3 через область SHD, но не связывается с PLCδ или PLCβ (Haendeler et al., 2003; Schmitz et al., 1997). GIT1 и PLCγ фосфорилируются Src-зависимым образом в ответ на различные агонисты, хотя на их ассоциацию это не влияет (Haendeler et al., 2003). Более того, подавление экспрессии GIT1 ингибирует опосредованное агонистами фосфорилирование PLCγ и высвобождение Ca 2+ (Haendeler et al., 2003). Эти данные предполагают, что олигомеры GIT-PIX действуют как каркас, который стабильно связывает PLCγ и рекрутирует вышестоящую киназу в ответ на стимуляцию агонистом.
Область coiled-coil
GIT1 и GIT2-long каждая содержит по три структуры coiled-coil. Два встречаются в области SHD и C-концевом PBS (Zhao et al., 2000). Оставшаяся намотанная катушка, которая находится между SHD и PBS, не является частью более крупного домена и поэтому называется просто «доменом спиральной катушки».Расчетные предсказания, что GIT1 и GIT2 гомо- и гетеродимеризуются с использованием предполагаемого мотива лейциновой молнии в этой области, были подтверждены коиммунопреципитацией (Kim et al., 2003; Paris et al., 2003; Premont et al., 2004). GIT1 и GIT2 также обнаруживаются во фракциях, подвижность которых согласуется с существованием димеров, когда клеточные лизаты разделяются градиентами плотности сахарозы или гель-фильтрацией (Kim et al., 2003; Paris et al., 2003; Premont et al., 2004 ). Эти взаимодействия, вместе с взаимодействием PIX и гомодимеризацией PIX, вероятно, обеспечивают основу для образования крупных олигомеров GIT-PIX, обсуждаемых выше.
Сайт связывания паксиллина
Паксиллин представляет собой адаптерный белок фокальной адгезии, который связывается с партнерами по связыванию через пять N-концевых мотивов LDXLLXXL (называемых мотивами LD) и четыре C-концевых домена LIM. GIT1 и GIT2-long связываются с областью LD4 паксиллина через свой PBS (остатки 643-679) (Brown et al., 2002; Di Cesare et al., 2000; Lamorte et al., 2003; Matafora et al., 2001). ; Mazaki et al., 2001; Turner et al., 1999; Zhao et al., 2000). Hic-5 и лейпаксин, члены суперсемейства паксиллинов, которые содержат мотивы LD, также связываются с GIT1 и GIT2-long (Gupta et al., 2003; Нишия и др., 2002; Turner et al., 1999). Взаимодействие с паксиллином локализует ЖКТ в фокальных комплексах; делеция либо мотива паксиллина LD4, либо области GIT PBS предотвращает ассоциацию GIT с фокальными комплексами (Brown et al., 2002; Matafora et al., 2001; West et al., 2001).
C-концевой фрагмент GIT1, содержащий только PBS, локализуется в фокальных комплексах более надежно, чем полноразмерный белок, что позволяет предположить, что область PBS обычно недоступна для связывания с паксиллином (Brown et al., 2002; Ди Чезаре и др., 2000; Manabe et al., 2002; Matafora et al., 2001; Paris et al., 2002). Вероятно, что ассоциация PAK с GIT-PIX демаскирует область PBS, способствуя связыванию паксиллина и привлечению его к фокальным комплексам. Эту идею подтверждают два результата. Во-первых, активированные Rac1 и Cdc42, которые заставляют PAK связываться с комплексами GIT-PIX, перемещают комплексы GIT-PIX в фокальные комплексы (Brown et al., 2002; Loo et al., 2004; Manser et al., 1997; Matafora et al. др., 2001; Шиката и др., 2003b).Во-вторых, мутант PAK, который не способен связывать PIX, блокирует локализацию GIT-PIX в фокальных комплексах (Brown et al., 2002).
Другие сайты связывания
GRK
GRK связываются и фосфорилируют GPCR, связанные с агонистами, что приводит к их интернализации через ямки, покрытые клатрином. GIT взаимодействуют напрямую с GRK через неизвестный сайт связывания (Premont et al., 1998; Premont et al., 2000). Поскольку рекрутирование GRK на плазматическую мембрану является ранним ответом на связывание агонистов с GPCR, это взаимодействие может вызывать агонист-зависимое рекрутирование GIT на плазматическую мембрану.В самом деле, GRK2-зависимое рекрутирование GIT на мембраны было продемонстрировано in vitro (Premont et al., 1998).
Фосфорилирование GIT
Известными киназами, фосфорилирующими GIT, являются Src и FAK. Сверхэкспрессия активных форм этих киназ увеличивает фосфорилирование GIT1 (Bagrodia et al., 1999; Kawachi et al., 2001; Yin et al., 2004), и мы показали Src-опосредованное фосфорилирование GIT1 в ответ на агонисты, включая ангиотензин II, EGF и тромбин (Haendeler et al., 2003; van Nieuw Amerongen et al., 2004; Инь и др., 2004). FAK-опосредованное фосфорилирование GITs только частично блокируется неактивным киназой мутантом FAK, это указывает на то, что каркасная функция FAK также важна для фосфорилирования GIT (Bagrodia et al., 1999). Недавние данные подтверждают, что фосфорилирование GIT2 необходимо для его рекрутирования в фокальные комплексы, хотя GIT1, по-видимому, не имеет такой потребности (Brown et al., 2005). Единственная фосфатаза, дефосфорилирующая GIT1, — это протеинтирозинфосфатаза ζ (PTPζ) (Kawachi et al., 2001), который, по-видимому, также связывается с GIT1 (Kawachi et al., 2001).
Функции ЖКТ
Динамика цитоскелета
Основная функция белков ЖКТ, по-видимому, заключается в регуляции динамики цитоскелета во время распространения и миграции клеток. Фосфорилирование ЖКТ и перемещение этих белков из цитоплазмы в очаговые комплексы происходит во время обоих процессов (Bagrodia et al., 1999; Lamorte et al., 2003; Manabe et al., 2002). Мутации GIT или паксиллина, которые предотвращают рекрутирование олигомеров GIT-PIX в фокальные комплексы, приводят к образованию многочисленных аномальных широких ламеллиподий во время распространения клеток из-за повышенной активности Rac1 (Brown et al., 2005; West et al., 2001). Rac1 активируется прикреплением клеток, что приводит к ассоциации PAK с GIT-PIX и серии событий, описанных выше, которые в конечном итоге приводят к ингибированию Rac1 с помощью активности GIT ARF-GAP.
GIT играют важную роль в поддержании правильной направленности клеточного движения, вероятно, ограничивая активность Rac передним краем клетки. GIT-содержащие комплексы перемещаются от заднего края к ведущему краю в мигрирующих клетках (Manabe et al., 2002). Блокирование взаимодействия желудочно-кишечного тракта с паксиллином увеличивает случайную подвижность клеток, вероятно, отражая растормаживание активности Rac1, что делает возможным неконтролируемое выпячивание и ретракцию клеток (Turner et al., 1999; West et al., 2001). ЖКТ также негативно регулируют RhoA и, следовательно, могут участвовать в разборке фокальных спаек на заднем крае (Mazaki et al., 2001; Shikata et al., 2003b; van Nieuw Amerongen et al., 2004; Zhao et al., 2000). .
GIT, по-видимому, выполняют специализированные функции цитоскелета в нейронах. Разрастание нейритов требует активности Rac и ARF6, а мутации GIT1, которые отменяют активность ARF-GAP, ингибируют этот процесс (Albertinazzi et al., 2003). GIT1 обогащен пре- и постсинаптической плотностью (Kim et al., 2003; Ко и др., 2003; Zhang et al., 2003), а ингибирование образования олигомеров GIT-PIX в культивируемых нейронах гиппокампа снижает количество синапсов, формируемых вдоль дендритов (Zhang et al., 2003).
Интернализация рецептора и перенос через мембрану
ЖКТ играют важную роль в регуляции интернализации рецептора через ямки, покрытые клатрином. Сверхэкспрессия GIT1 и GIT2-long нарушает нормальную интернализацию некоторых рецепторов, связанных с агонистами, из плазматической мембраны, включая β 1 и β 2 -адренергический, аденозиновый 2B, μ-опиоидный, мускариновый M1 и EGF рецепторы (Claing и другие., 2000; Премонт и др., 1998; Premont et al., 2000). В результате клетки не повторно чувствительны к ассоциированным агонистам. Другие рецепторы, включая VIP 1 , мускариновые рецепторы M2, эндотелин B и ангиотензин II, которые могут интернализоваться через механизмы, отличные от ямок, покрытых клатрином, не подвержены избыточной экспрессии GIT (Claing et al., 2000).
ARF6 является центральным медиатором в мембранном переносе между клеточной поверхностью и эндосомами. Мутанты ARF6, конститутивно связанные либо с GDP, либо с GTP, ингибируют интернализацию и ресенсибилизацию рецептора аналогично сверхэкспрессии GIT (Claing et al., 2001). Устранение активности ARF-GAP устраняет эффект сверхэкспрессии GIT на интернализацию рецепторов (Premont et al., 1998). Неясно, как активность ARF-GAP регулирует перенос рецепторов, связанных с агонистами, с поверхности клетки на рециркулирующие эндосомы, а затем обратно на поверхность клетки. Рекрутирование GITs на клеточную мембрану посредством их взаимодействия с GRKs может быть задействовано, но дальнейшая работа будет необходима для выяснения механизма.
Недавние данные свидетельствуют о том, что GIT1 может участвовать в измененном мембранном переносе, который способствует развитию болезни Хантингтона.GIT1 ассоциирует с патогенным мутантом белка хантингтина (Goehler et al., 2004). Агрегация этого мутанта увеличивается в ответ на экспрессию мутанта GIT1, который не обладает активностью ARF-GAP (Goehler et al., 2004). В нейронах, культивируемых от пациентов с болезнью Хантингтона, наблюдаются низкомолекулярные варианты GIT1, и они могут представлять собой N-концевые делеции, лишенные активности ARF-GAP (Goehler et al., 2004). ЖКТ также взаимодействуют с пресинаптическими нейронными белками piccolo и scribble, которые участвуют в организации и высвобождении пресинаптических пузырьков (Audebert et al., 2004; Ким и др., 2003). Кроме того, они взаимодействуют с постсинаптическим белком липрин-α, который закрепляет рецепторы глутамата AMPA на постсинаптических плотностях (Ko et al., 2003).
В нескольких сообщениях предполагается, что белки ЖКТ играют роль в инфицировании ВИЧ. Подавление CD4 на поверхности клетки и главного комплекса гистосовместимости (MHC) класса I в клетке-хозяине вирусным белком Nef происходит вскоре после заражения. Интернализация MHC класса I опосредуется ARF6 (Благовещенская и др., 2002).Механизм, с помощью которого Nef способствует этому процессу, неизвестен, хотя он связывается и активирует PAK, и при этом связывается с олигомерами GIT-PIX. Это повышает вероятность того, что он влияет на активность ARF6 через ЖКТ (Brown et al., 1999).
Заключение
Белки GIT функционируют в регуляции структуры цитоскелета, мембранном переносе и формировании сигнальных каскадов. Ясно, что они играют важную роль в пространственной локализации сигнальных молекул и, следовательно, в полярности клеток.Возрастающий интерес к белкам GIT привел к описанию множества взаимодействующих белков, что указывало на их особые роли в нейронах и других типах клеток. Захватывающие недавние результаты также предполагают возможную патогенную роль белков ЖКТ в болезни Хантингтона и ВИЧ-инфекции.
Будущие исследования будут дополнительно выяснять механизмы, с помощью которых эти белки регулируют различные клеточные функции, включая перенос через мембрану, а также сборку и разборку фокальной адгезии.По мере того, как мы узнаем больше, связи и общие черты между этим разнообразным набором функций могут пролить дополнительный свет на способ, с помощью которого клетки координируют эти действия для достижения более сложных задач — например, координации динамики цитоскелета и мембран для движения клеток. Исследования in vivo будут важны для подтверждения физиологической важности большого количества результатов, которые уже были задокументированы в клеточных системах. Наконец, дальнейшее применение наших знаний об этих белках к тому, что известно о ВИЧ-инфекции и болезни Хантингтона, а также других болезненных состояниях, может дать новые диагностические или терапевтические инструменты.
- Принято 6 февраля 2006 г.
- © The Company of Biologies Limited 2006
Ссылки
- ↵
Albertinazzi, C., Za, L., Paris, S. and de Curtis, I. (2003). Фактор ADP-рибозилирования 6 и функциональный комплекс PIX / p95-APP1 необходимы для опосредованного Rac1B роста нейритов. Мол. Биол. Cell 14, 1295-1307.
- ↵
Арковиц, Р. А. и Лоу, Н. (1997). Небольшой консервативный домен в дрожжевом Spa2p необходим и достаточен для его поляризованной локализации.J. Cell Biol. 138, 17-36.
- ↵
Audebert, S., Navarro, C., Nourry, C., Chasserot-Golaz, S., Lecine, P., Bellaiche, Y., Dupont, JL, Premont, RT, Sempere, C., Strub, JM et al. (2004). Наброски млекопитающих образуют плотный комплекс с фактором обмена betaPIX. Curr. Биол. 14, 987-995.
- ↵
Багродиа, С., Бейли, Д., Ленард, З., Харт, М., Гуан, Дж. Л., Премонт, Р. Т., Тейлор, С.Дж. И Церионе, Р. А. (1999). Фосфорилированный тирозином белок, который связывается с важной регуляторной областью семейства Cool р21-активируемых киназ-связывающих белков. J. Biol. Chem. 274, 22393-22400.
- ↵
Благовещенская, А. Д., Томас, Л., Фелициангели, С. Ф., Хунг, К. Х. и Томас, Г. (2002). Nef ВИЧ-1 подавляет MHC-I с помощью регулируемого PACS-1 и PI3K пути эндоцитоза ARF6. Ячейка 111, 853-866.
- ↵
Коричневый, А., Ван Х., Савай Э. и Ченг-Майер К. (1999). Активация PAK-родственной киназы Nef вируса иммунодефицита человека типа 1 в первичных лимфоцитах и макрофагах периферической крови человека приводит к фосфорилированию комплекса PIX-p95. J. Virol. 73, 9899-9907.
- ↵
Браун, М. К., Уэст, К. А. и Тернер, К. Э. (2002). Паксиллин-зависимый линкер паксиллинкиназы и p21-активированная киназа локализация в очаговых адгезиях включает многоэтапный путь активации.Мол. Биол. Cell 13, 1550-1565.
- ↵
Браун, М. К., Кэри, Л. А., Джеймисон, Дж. С., Купер, Дж. А. и Тернер, К. Е. (2005). Киназы Src и FAK взаимодействуют для фосфорилирования линкера паксиллинкиназы, стимулируют локализацию его очаговой адгезии и регулируют распространение и протрузию клеток. Мол. Биол. Ячейка 16, 4316-4328.
- ↵
Claing, A., Perry, S.J., Achiriloaie, M., Walker, J.K., Albanesi, J.P., Lefkowitz, R.Дж. И Премонт Р. Т. (2000). Множественные эндоцитарные пути рецепторов, связанных с G-белком, определяемые чувствительностью GIT1. Proc. Natl. Акад. Sci. USA 97, 1119-1124.
- ↵
Claing, A., Chen, W., Miller, W. E., Vitale, N., Moss, J., Premont, R. T. and Lefkowitz, R. J. (2001). Опосредованная бета-аррестином активация фактора 6 АДФ-рибозилирования и эндоцитоз бета 2-адренорецепторов. J. Biol. Chem. 276, 42509-42513.
- ↵
Цукерман, Э., Хубер, И., Ротман, М. и Кассель, Д. (1995). Белок, активирующий ГТФазу ARF1: мотив цинкового пальца и локализация комплекса Гольджи. Наука 270, 1999-2002 гг.
- ↵
Ди Чезаре, А., Пэрис, С., Альбертинацци, К., Дариоцци, С., Андерсен, Дж., Манн, М., Лонги, Р. и де Кертис, И. (2000). p95-APP1 связывает мембранный транспорт с Rac-опосредованной реорганизацией актина. Nat. Cell Biol. 2, 521-530.
- ↵
Feng, Q., Олбек, Дж. Г., Церионе, Р. А. и Янг, В. (2002). Регулирование белков Cool / Pix: ключевых партнеров по связыванию мишеней Cdc42 / Rac, киназ, активируемых p21. J. Biol. Chem. 277, 5644-5650.
- ↵
Герунг, С. и Снайдер, М. (1990). Ген SPA2 Saccharomyces cerevisiae важен для индуцированного феромонами морфогенеза и эффективного спаривания. J. Cell Biol. 111, 1451–1464.
- ↵
Goehler, H., Lalowski, M., Stelzl, U., Waelter, S., Stroedicke, M., Worm, U., Droege, , A., Lindenberg, K. S., Knoblich, M., Haenig, C. et al. (2004). Сеть взаимодействия белков связывает GIT1, усилитель агрегации хантингтина, с болезнью Хантингтона. Мол. Cell 15, 853-865.
- ↵
Голдберг, Дж. (1999). Структурный и функциональный анализ комплекса ARF1-ARFGAP показывает роль коатомера в гидролизе GTP. Ячейка 96, 893-902.
- ↵
Гупта, А., Ли, Б. С., Хадир, М. А., Танг, З., Челлайя, М., Абу-Амер, Ю., , Голдкнопф, Дж. И Хруска, К. А. (2003). Лейпаксин является важным адаптерным белком в зоне адгезии остеокласта. J. Bone Miner. Res. 18, 669-685.
- ↵
Хенделер, Дж., Ходжо, Ю., Эберсолд, Р., Ян, К. и Берк, Б. С. (2000). Фосфорилирование GIT1, стимулированное ангиотензином II, определяет относительную активацию PLCγ и ERK1 / 2. Тираж 102, II-15.
- ↵
Haendeler, J., Инь, Г., Ходжо, Ю., Сайто, Ю., Мелараньо, М., Ян, К., Шарма, В. К., , , Хеллер, М., Эберсолд, Р. и Берк, Б. С. (2003). GIT1 опосредует Src-зависимую активацию фосфолипазы Cgamma ангиотензином II и эпидермальным фактором роста. J. Biol. Chem. 278, 49936-49944.
- ↵
Hofmann, C., Shepelev, M. and Chernoff, J. (2004). Генетика Пак. J. Cell Sci. 117, 4343-4354.
- ↵
Кавачи, Х., Фудзикава А., Маэда Н. и Нода М. (2001). Идентификация GIT1 / Cat-1 как молекулы субстрата протеинтирозинфосфатазы zeta / beta системой улавливания субстрата дрожжей. Proc. Natl. Акад. Sci. USA 98, 6593-6598.
- ↵
Ким, С., Ли, С. Х. и Парк, Д. (2001). Опосредованная лейциновой застежкой-молнией гомодимеризация р21-активированного фактора взаимодействия с киназой, бета-Pix. Значение роли в реорганизации цитоскелета. J. Biol. Chem. 276, 10581-10584.
- ↵
Kim, S., Ko, J., Shin, H., Lee, JR, Lim, C., Han, JH, Altrock, WD, Garner, C. C., Gundelfinger , ED, Premont, RT et al. (2003). Семейство белков GIT образует мультимеры и ассоциируется с пресинаптическим белком цитоматрикс пикколо. J. Biol. Chem. 278, 6291-6300.
- ↵
Ko, J., Kim, S., Valtschanoff, J. G., Shin, H., Lee, J. R., Sheng, M., Premont, R. T., Weinberg, R.Дж. И Ким, Э. (2003). Взаимодействие между липрином-альфа и GIT1 необходимо для нацеливания на рецептор AMPA. J. Neurosci. 23, 1667–1677.
- ↵
Ламорте, Л., Родригес, С., Сангван, В., Тернер, К. Э. и Парк, М. (2003). Crk связывается с мультимолекулярным комплексом паксиллин / GIT2 / бета-PIX и способствует Rac-зависимой релокализации паксиллина в очаговые контакты. Мол. Биол. Cell 14, 2818-2831.
- ↵
Лоо, Т.Х., Нг, Ю. В., Лим, Л. и Мансер, Э. (2004). GIT1 активирует p21-активированную киназу по механизму, независимому от связывания p21. Мол. Клетка. Биол. 24, 3849-3859.
- ↵
Манабе Р., Коваленко М., Уэбб Д. Дж. И Хорвиц А. Р. (2002). GIT1 функционирует в подвижном многомолекулярном сигнальном комплексе, который регулирует протрузионную активность и миграцию клеток. J. Cell Sci. 115, 1497-1510.
- ↵
Manser, E., Huang, H.Y., Loo, T.H., Chen, X.Q., Dong, J.M., Leung, T. and Lim, L. (1997). Экспрессия конститутивно активного альфа-PAK выявляет эффекты киназы на актин и фокальные комплексы. Мол. Клетка. Биол. 17, 1129–1143.
- ↵
Manser, E., Loo, TH, Koh, CG, Zhao, ZS, Chen, XQ, Tan, L., Tan, I., Leung, T. и Lim, L. (1998). Киназы PAK напрямую связаны с семейством факторов обмена нуклеотидов PIX. Мол. Cell 1, 183–192.
- ↵
Матафора, В., Пэрис, С., Дариоцци, С. и де Кертис, И. (2001). Молекулярные механизмы, регулирующие субклеточную локализацию p95-APP1 между компартментом рециклинга эндосом и сайтами организации актина на поверхности клетки. J. Cell Sci. 114, 4509-4520.
- ↵
Мазаки, Ю., Хашимото, С., Окава, К., Цубучи, А., Накамура, К., Яги, Р., Яно, Х., Кондо, А., Ивамацу, А., Мидзогути, А.и другие. (2001). Фактор АДФ-рибозилирования GTPase-активирующий белок Git2-short / KIAA0148 участвует в субклеточной локализации паксиллина и организации цитоскелета актина. Мол. Биол. Ячейка 12, 645-662.
- ↵
Nishiya, N., Shirai, T., Suzuki, W. and Nose, K. (2002). Hic-5 взаимодействует с GIT1 с другим способом связывания, чем паксиллин. J. Biochem. 132, 279-289.
- ↵
Nishiya, N., Kiosses, W. B., Han, J.и Гинзберг, М. Х. (2005). Комплекс альфа4-интегрин-паксиллин-Arf-GAP ограничивает активацию Rac передним краем мигрирующих клеток. Nat. Cell Biol. 7, 343-352.
- ↵
Охара, О., Нагасе, Т., Исикава, К., Накадзима, Д., Охира, М., Секи, Н. и Номура, Н. (1997). Конструирование и характеристика библиотек кДНК головного мозга человека, подходящих для анализа клонов кДНК, кодирующих относительно большие белки. ДНК Res. 4, 53-59.
- ↵
Paris, S., Za, L., Sporchia, B. and de Curtis, I. (2002). Анализ субклеточного распределения птичьего p95-APP2, ARF-GAP, ортолога линкеру паксиллинкиназы млекопитающих. Int. J. Biochem. Cell Biol. 34, 826-837.
- ↵
Paris, S., Longhi, R., Santambrogio, P. and de Curtis, I. (2003). Опосредованная лейцином «застежка-молния» гомо- и гетеродимеризация белка, активирующего ГТФазу p95-ARF семейства GIT, PIX-, взаимодействующих с паксиллином белков 1 и 2. Biochem. J. 372, 391-398.
- ↵
Премонт, Р. Т. и Витале, Н. (2001). Очистка и характеристика GIT семейства факторов ADP-рибозилирования (ARF) белков, активирующих GTPase. Методы Энзимол. 329, 335-343.
- ↵
Premont, RT, Claing, A., Vitale, N., Freeman, JL, Pitcher, JA, Patton, WA, Moss, J., Vaughan, M. and Lefkowitz, RJ (1998). регуляция бета2-адренорецепторов с помощью GIT1, G-белок-связанный с рецепторным киназой фактор рибозилирования АДФ, белок, активирующий ГТФазу.Proc. Natl. Акад. Sci. USA 95, 14082-14087.
- ↵
Premont, R.T., Claing, A., Vitale, N., Perry, S.J. и Lefkowitz, R.J. (2000). Семейство GIT белков, активирующих ГТФазу фактора АДФ-рибозилирования. Функциональное разнообразие GIT2 за счет альтернативного сплайсинга. J. Biol. Chem. 275, 22373-22380.
- ↵
Premont, R. T., Perry, S. J., Schmalzigaug, R., Roseman, J. T., Xing, Y. and Claing, A. (2004).Комплекс GIT / PIX: олигомерная сборка белков, активирующих GTPase ARF семейства GIT и факторов обмена гуаниновых нуклеотидов Rac1 / Cdc42 семейства PIX. Клетка. Сигнал. 16, 1001-1011.
- ↵
Шмитц, У., Исида, М., Исида, Т. и Берк, Б.С. (1997). Ангиотензин II стимулирует фосфорилирование тирозина белков, связанных с PLC-γ: характеристика c-Src-зависимого белка 97 кДа в гладкомышечных клетках сосудов. Circ. Res. 81, 550-557.
- ↵
Шеу, Ю.Дж., Сантос, Б., Фортин, Н., Костиган, К. и Снайдер, М. (1998). Spa2p взаимодействует с белками клеточной полярности и сигнальными компонентами, участвующими в морфогенезе дрожжевых клеток. Мол. Клетка. Биол. 18, 4053-4069.
- ↵
Шиката Ю., Бирюков К. Г., Бирюкова А. А., Верин А. и Гарсиа Дж. Г. (2003a). Участие сайт-специфического фосфорилирования FAK в индуцированном сфингозин-1 фосфатом и тромбином ремоделировании фокальной адгезии: роль Src и GIT. FASEB J.17, 2240-2249.
- ↵
Шиката Ю., Бирюков К. Г. и Гарсия Дж. Г. (2003b). S1P индуцирует ремоделирование ЖК в эндотелиальных клетках легких человека: роль Rac, GIT1, FAK и паксиллина. J. Appl. Physiol. 94, 1193–1203.
- ↵
Snyder, M. (1989). Белок SPA2 дрожжей локализуется в местах роста клеток. J. Cell Biol. 108, 1419–1429.
- ↵
Тернер, К. Э., Браун, М.К., Перротта, Дж. А., Риди, М. С., Николопулос, С. Н., , , Макдональд, А. Р., Багродиа, С., Томас, С. и Левенталь, П. С. (1999). Мотив паксиллина LD4 связывает PAK и PIX посредством нового 95-кДа анкиринового повтора, белка ARF-GAP: роль в ремоделировании цитоскелета. J. Cell Biol. 145, 851-863.
- ↵
Учида, Х., Кондо, А., Йошимура, Й., Мазаки, Ю. и Сабе, Х. (2001). PAG3 / Papalpha / KIAA0400, белок, активирующий GTPase для фактора ADP-рибозилирования (ARF), регулирует ARF6 при фагоцитозе макрофагов, опосредованном рецептором Fcgamma.J. Exp. Med. 193, 955-966.
- ↵
van Nieuw Amerongen, GP, Natarajan, K., Yin, G., Hoefen, RJ, Osawa, M., Haendeler, J., Ridley, AJ, Fujiwara, K., van Хинсберг, В. и Берк, BC (2004). GIT1 обеспечивает передачу сигналов тромбина в эндотелиальных клетках: роль в обмене фокальных спаек RhoA-типа. Circ. Res. 94, 1041-1049.
- ↵
Витале, Н., Паттон, В. А., Мосс, Дж., Воган, М., Лефковиц, Р.J. and Premont, R. T. (2000). Белки GIT, новое семейство фосфатидилинозитол 3,4,5-трифосфат-стимулированных белков, активирующих GTPase для ARF6. J. Biol. Chem. 275, 13901-13906.
- ↵
Вест, К. А., Чжан, Х., Браун, М. К., Николопулос, С. Н., Риди, М. К., Хорвиц, , А. Ф. и Тернер, К. Э. (2001). Мотив LD4 паксиллина регулирует распространение и подвижность клеток посредством взаимодействия с линкером паксиллинкиназы (PKL).J. Cell Biol. 154, 161-176.
- ↵
Инь, Г., Хенделер, Дж., Ян, К. и Берк, Б. С. (2004). GIT1 функционирует как каркас для активации киназы 1 и 2, регулируемой внеклеточными сигналами MEK1, ангиотензином II и эпидермальным фактором роста. Мол. Клетка. Биол. 24, 875-885.
- ↵
Инь, Г., Чжэн, К., Янь, К. и Берк, Б. С. (2005). GIT1 является каркасом для активации ERK1 / 2 в фокальных сращениях. J. Biol. Chem. 280, 27705-27712.
- ↵
Zhang, H., Webb, D. J., Asmussen, H. and Horwitz, A. F. (2003). Формирование синапсов регулируется сигнальным адаптером GIT1. J. Cell Biol. 161, 131–142.
- ↵
Чжао, З. С., Мансер, Э., Лоо, Т. Х. и Лим, Л. (2000). Связывание взаимодействующего с PAK фактора обмена PIX с GIT1 способствует разборке фокального комплекса. Мол. Клетка. Биол. 20, 6354-6363.
- ↵
Чжао, З.С., Лим, Дж. П., Нг, Ю. В., Лим, Л. и Мансер, Э. (2005). GIT-ассоциированная киназа PAK нацелена на центросому и регулирует Aurora-A. Мол. Cell 20, 237-249.
Белки
Аминокислоты
Белки — самые разнообразные биомолекулы на Земле, выполняющие множество функций, необходимых для жизни. Белковые ферменты являются биологическими катализаторами, поддерживающими жизнь, регулируя, где и когда происходят клеточные реакции. Структурные белки обеспечивают внутреннюю и внешнюю поддержку для защиты и поддержания формы клеток.Например, кератины представляют собой важный класс структурных белков, обнаруженных в волосах, коже, ногтях и перьях животных. Белки подвижности обеспечивают основу для движения клеток и всего организма, включая белки мышечных двигателей, которые могут перемещать целые животные! Мембранные белки передают сигналы во время межклеточной коммуникации, транспортируют молекулы в клетки и из них и защищают живые организмы, идентифицируя и помеча захватчиков.
Функции белков настолько разнообразны из-за множества уникальных трехмерных структур, которые образуют белковые полимеры.Несмотря на такое разнообразие, белки также имеют несколько общих структурных характеристик своих мономеров — аминокислот. Структурное сходство аминокислот делает синтез белка единообразным и регулируемым процессом; однако каждая аминокислота также содержит уникальный структурный компонент. Конкретные различия между каждой аминокислотой взаимодействуют, создавая уникальные трехмерные белковые структуры. В совокупности сходства и различия между аминокислотами объясняют, как клетки могут создавать разнообразный пул белков из одного и того же набора строительных блоков.
В каждой аминокислоте существует один центральный атом углерода — альфа-углерод (альфа-углерод). Из четырех групп атомов, ковалентно связанных с α-углеродом, три одинаковы для всех аминокислот. -Углерод всегда напрямую связан с одной аминогруппой и одной карбоксильной группой (карбоновой кислотой). Название «аминокислота» происходит от наличия этих двух функциональных групп (аминокислота + кислота). Все аминокислоты имеют третью общую ковалентную связь с атомом водорода, но четвертый атом (или атомная группа), связанный с α-углеродом, уникален в каждой аминокислоте.
Четвертая α-углеродная связь может соединяться с другим одиночным атомом водорода, как в глицине, или с группой атомов. Группы атомов различаются как по размеру, так и по полярности или заряду. Например, лизин содержит большую ионную группу атомов. Для простоты, когда конкретная аминокислота не идентифицирована, биологи используют термин «R-группа» для обозначения четвертого атома или группы, связанной с α-углеродом. Термин «R» обозначает остальную часть молекулы и используется при обсуждении общей структуры и реакционной способности аминокислот без усложнения структуры включением деталей R-группы.
Синтез белка включает построение полимера из аминокислот со сложной трехмерной структурой. Синтез дегидратации образует пептидную связь между аминокислотами и высвобождает молекулу воды. Дипептид образуется, когда между двумя отдельными аминокислотами создается пептидная связь, соединяющая углерод карбоксильной группы одной аминокислоты и азот аминогруппы другой аминокислоты. Поскольку дополнительные аминокислоты связываются посредством синтеза дегидратации, короткая цепь (пептид) растет.Полипептиды образуются, когда длина пептидной цепи достигает ста или более аминокислот. Белки образуются в виде аминокислот в одном или нескольких полипептидах, химически взаимодействуя с образованием сложной трехмерной структуры.
Живые организмы синтезируют почти все белки, используя всего двадцать различных аминокислот. Полипептиды образуют уникальную трехмерную структуру, основанную на типе и положении (последовательности) этих аминокислот. Внутри последовательности R-группы аминокислот образуют химические взаимодействия, которые создают определенную трехмерную структуру.Эти R-группы обычно называют «боковыми цепями», потому что они не участвуют в пептидных связях. R-группы выступают на стороне полипептида, позволяя им химически взаимодействовать друг с другом. Взаимодействия с боковыми цепями образуют специфическую структуру каждого белка, структуру, уникально способную выполнять клеточную функцию этого белка.
Функциональные группы белков
Это задание проверяет вашу способность определять функциональные группы аминокислот в белках.
Построение и расщепление белков
Это задание проверяет вашу способность идентифицировать реагенты и продукты синтеза и гидролиза белка.
Структура и функция белка
В отличие от полисахаридов, полипептидные цепи собраны с широким спектром аминокислот в каждом полимере. Набор из двадцати аминокислот, обычно содержащихся в биологических белках, напрямую отвечает за разнообразие белковых структур в живых клетках.Каждый белок отличается по нескольким аспектам, которые определяют структуру и, следовательно, функцию. Белок может состоять из одной или нескольких полипептидных цепей. Гены клетки определяют длину каждой полипептидной цепи, а также тип и положение каждой аминокислоты в последовательности. Вместе эти факторы определяют структуру белка, которая определяет функцию, которую белок может выполнять.
Как структура белка определяет функцию? Трехмерная форма каждого белка идеально подходит для выполнения одной конкретной функции.Например, аквапорины — это канальные белки, которые образуют небольшие туннели через клеточную мембрану. Внутренняя поверхность аквапориновых туннелей имеет определенный диаметр и полярность. Эта структура идеально подходит для переноса молекул воды, но очень немногого другого, обеспечивая специфичность и функцию. Если структура белка изменяется, меняется и его способность функционировать.
Зная важность структуры белка в определении функции, как тогда определяется структура белка? Чтобы ответить на этот вопрос, мы должны сначала спросить, как только двадцать аминокислот могут создать разнообразие белков, которые мы видим в живых организмах.Это разнообразие легко объяснить тем, как полипептиды образуют последовательность. Представьте себе создание дипептида с использованием двадцати распространенных аминокислот. Существует двадцать вариантов для первого положения и двадцать вариантов для второго положения этого двух аминокислотного пептида. Математические расчеты говорят нам, что мы могли синтезировать четыреста различных дипептидов! На каждые дополнительных аминокислот в пептиде мы снова умножаем это количество вариантов на двадцать. Представьте себе, сколько различных полипептидов может существовать в природе, имея более ста аминокислот в средней последовательности!
Помимо увеличения вариативности, каждая из двадцати общих аминокислот играет жизненно важную роль в структуре и функции белков во всех живых организмах.В то время как производители, такие как растения, синтезируют все двадцать распространенных аминокислот, потребители, которые получают энергию, поедая биомолекулы, полагаются на потребление с пищей для получения одной или нескольких аминокислот. Люди синтезируют десять из двадцати обычных аминокислот, но оставшиеся десять должны быть получены с пищей. Хотя всех аминокислот необходимы для жизни человека, «незаменимые аминокислоты» — это те аминокислоты, которые человек не может синтезировать самостоятельно. Употребление в пищу продуктов, богатых белком, обеспечивает клетки этими незаменимыми аминокислотами.
Живые организмы, управляемые генами, синтезируют полипептиды с использованием аминокислот. Уникальный порядок аминокислот в полипептиде называется первичной структурой и представляет собой первый уровень трехмерной структуры (конформации) белка. Первичная структура определяет каждый дополнительный уровень химических взаимодействий, управляя формированием окончательной конформации белка.
Если структура определяет функцию, как первичная последовательность аминокислот определяет трехмерную структуру? В процессе, называемом сворачиванием белка, стабильные химические взаимодействия образуются между аминокислотами в белке, изгибая и скручивая полимер в трехмерную форму.Сворачивание белков иногда требует помощи молекулярных белков-шаперонов, которые связывают вновь образующиеся полипептиды и способствуют формированию структуры.
Сворачивание белка включает три уровня химических взаимодействий, называемых вторичной, третичной и четвертичной структурой. Вторичная структура создается за счет образования водородных связей между соседними аминокислотами во время синтеза белка. Водородные связи во вторичной структуре включают полярные амино- и карбоксильные группы аминокислот, но не включают R-группы.По мере того как пептидная цепь продолжает расти, взаимодействия между боковыми цепями аминокислот (R-группами) образуют третичную структуру полипептида. Боковые цепи взаимодействуют друг с другом:
- образование водородных связей в боковой цепи.
- агрегация гидрофобных боковых цепей.
- образование ионных (солевой мостик) и ковалентных (дисульфидный мостик) связей.
Хотя все химические взаимодействия важны для третичной структуры, белки сворачиваются в основном в ответ на то, какие боковые цепи способны образовывать водородные связи с водой.Поскольку молекулы воды составляют большую часть внутреннего раствора клетки, неполярные боковые цепи исключаются из раствора и объединяются по мере образования водородных связей с полярными и ионными боковыми цепями. Эти гидрофобные взаимодействия являются сильнейшим фактором, определяющим третичную структуру.
У некоторых белков сворачивание завершается после образования третичной структуры. В других случаях несколько полипептидных цепей объединяются, образуя четвертый уровень структуры, четвертичную структуру. Четвертичная структура включает два или более полипептидов, складывающихся вместе посредством тех же типов химических взаимодействий, которые сформировали третичную структуру.В четвертичной структуре боковые цепи разных полипептидов образуют водородные связи, гидрофобные взаимодействия и химические связи друг с другом. Гемоглобин, белок, переносящий кислород через кровоток, состоит из четырех полипептидов.
Что делать, если что-то нарушает структуру белка? Сильная жара, изменения pH и химические токсины — это лишь некоторые из причин денатурации белка, потери естественной структуры белка. Некоторые белки способны к рефолдингу, но большинство белков не могут восстановиться после значительной потери структуры белка.Например, приготовление яйца навсегда денатурирует его белки, изменяя внешний вид и текстуру яйца. Живые клетки затрачивают значительные усилия на поддержание гомеостаза, контролируя их внутреннюю среду, потому что неожиданные изменения могут разрушить белки клетки, убивая клетку.
Поскольку функция белка зависит от точного формирования структуры, сворачивание белка является ключевой темой научных исследований. Многие биохимики посвящают всю свою карьеру поиску способов предсказать, как будут складываться белки и как мутации повлияют на структуру и функцию белков.Мутации, которые изменяют первичную последовательность белка, могут привести к массивным изменениям в структуре белка и устранить или изменить функцию, что приведет к болезни или смерти. Иногда мутации приводят к улучшенным или новым функциям, приносящим пользу организму. Редкие полезные мутации распространяются среди популяций посредством естественного отбора, что приводит к эволюционным изменениям.
Денатурация белка
Эта анимация иллюстрирует процесс денатурации.
Белковые термины
Это задание проверяет вашу способность сопоставлять термины, относящиеся к белкам, с их определениями.
Учеными созданы многофункциональные белково-полимерные пленки
ИЗОБРАЖЕНИЕ: Молекула дендримера отмечена желтым цветом. Поверхность белковой молекулы имеет цветовую маркировку в соответствии с химическими свойствами аминокислотных остатков (красный — положительный заряд, синий — отрицательный … посмотреть еще
Кредит: Владимир Муронец
Команда из МГУ вместе с зарубежными и российскими коллегами обнаружила, что при смешивании дендримеров (древовидных полимеров) и белков самопроизвольно образуются многослойные пленки.Они легко образуются и сохраняют активность и функцию белковых ферментов, что определяет их потенциал как материала для создания биосенсоров и медицинских изделий. Результаты исследования опубликованы в журнале Polymer .
Сегодня известно огромное количество полимеров, различающихся по структуре, составу и свойствам. Один из самых интересных примеров — дендримеры — древовидные макромолекулы. Они устроены следующим образом: к центральному ядру присоединены три химические группы, каждая из которых разветвляется на две одинаковые группы и так далее, и так далее.Такая структура достигается многоступенчатым синтезом.
Количество точек ветвления определяет номер поколения дендримера: полимер первого поколения имеет одну точку ветвления, второй — две, третий — три и так далее. Чем дальше, тем более плотной и сферической становится структура, а ее физические и химические свойства задаются функциональными группами на внешнем слое. Дендримеры способны образовывать поверхностные полости, в которые могут быть заключены молекулы, и это свойство было главной предпосылкой для активного изучения этих полимеров.Однако ученые МГУ нашли для дендримеров совсем другое применение.
«Мы обнаружили, что при смешивании белков с дендримерами четвертого поколения происходит самосборка многослойных нанопленок толщиной 200-700 нм. Они могут прилегать к стеклянным или пластиковым поверхностям, а также образовываться на границе раздела жидкость-воздух», — говорит Владимир Муронец, профессор факультета биоинженерии и биоинформатики и биологического факультета МГУ, заведующий кафедрой биохимии клеток животных в А.Институт физико-химической биологии им. Н. Белозерского МГУ.
Ученые провели эксперименты по включению в состав нанопленок различных ферментов: лизоцима, разрушающего стенки бактериальных клеток, и протеиназ нескольких типов, расщепляющих белки. Был сделан вывод, что в составе нанопленок эти белки способны сохранять активность около двух недель. Эта двухкомпонентная система устойчива к действию чистящих средств (детергентов), к изменениям кислотности среды и в целом стабильна при хранении.Однако основным преимуществом получаемых пленок является простота процесса их формирования за счет самосборки.
«Мы считаем, что пленки белок-дендример являются перспективным материалом для создания биосенсоров, а также могут быть использованы в медицине в качестве биоактивного перевязочного материала», — заключает Владимир Муронец.
Работа выполнена совместно с учеными Первого МГМУ им. И.М. Сеченова; Институт элементоорганических соединений им. Несмеянова РАН; Институт органической химии им. Зелинского Российской академии наук и Французский национальный институт сельскохозяйственных исследований.
###
Заявление об отказе от ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
.
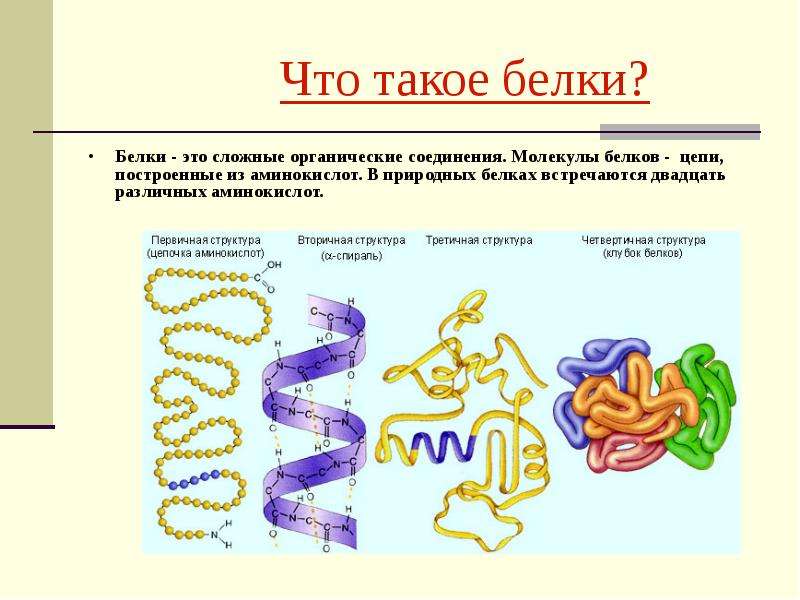 Люблина
Люблина
 Общество. Медицина»
Общество. Медицина»
 Барановичи)
Барановичи)
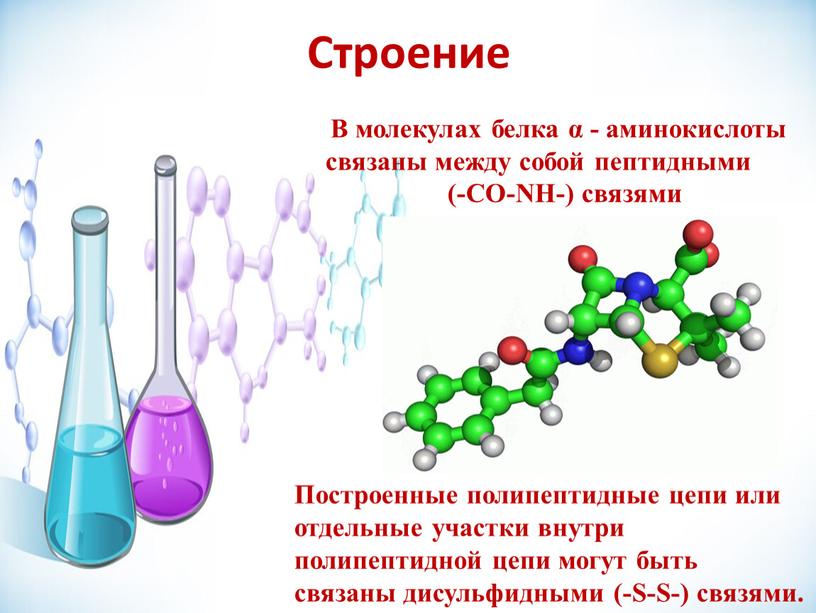 10.2017
10.2017
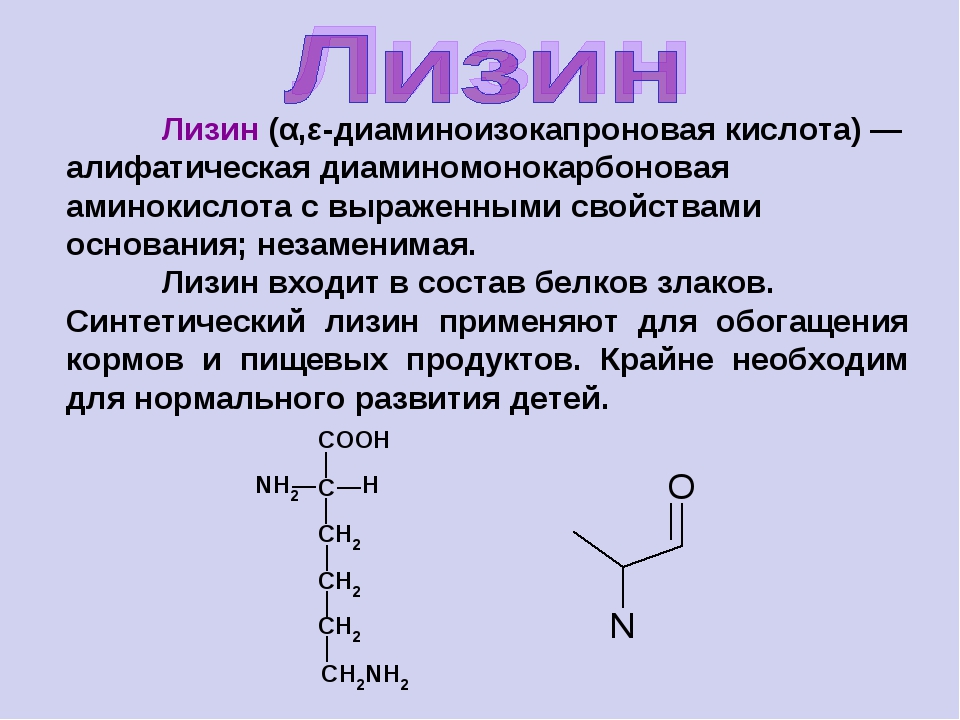 м.н. О.О. Руммо
м.н. О.О. Руммо
 Гродно
Гродно